EJE TEMÁTICO: APLICANDO Y EVALUANDO SOLUCIONES SOSTENIBLES CON RESPONSABILIDAD SOCIAL ANTE RETOS EMPRESARIALES.
CONTENIDOS TEMÁTICOS
PERIODO
|
INDICADORES DE LOGRO
|
ESTRATEGIAS/RECOMENDACIONES
|
I
|
ÁCIDOS Y BASES
Definiciones
Electrolitos débiles Conducción metálica-Electrolítica
Electrólisis
Estequiometria de la electrolisis
Pilas voltaicas
Potencial de los electrodos
La corrosión del
hierro.
La ionización del agua
pH
Indicadores
Titulaciones
CINÉTICA QUÍMICA
Velocidad de las reacciones
Concentración y velocidad de reacción
Mecanismos de las reacciones
Ecuaciones de velocidad de reacción y temperatura
Catálisis
EQUILIBRIO QUÍMICO
Reacciones reversibles y equilibrio químico
Constante de Equilibrio
Principio de Le Chatelier
Cálculo de la constante de equilibrio
ELECTRO QUÍMICA
Reacciones de oxidación reducción
Balanceo por oxidación reducción
Celdas Voltaicas
QUÍMICA DEL CARBONO
Conceptos básicos
Propiedades del Carbono
Configuración electrónica orbital atómica y molecular.
Origen de los compuestos orgánicos
|
Explicación por parte del docente
Realización de talleres
Elaboración de diversos mapas conceptuales.
Elaboración de mentefactos
Consulta en diversos textos
Realización de actividades lúdicas con los temas
vistos (stop, sopa de letras, crucigramas,)
Practica de laboratorio
Informe de laboratorio
Quiz
Evaluación parcial
Retroalimentación de las evaluaciones realizadas
Lectura de artículos científicos
Elaboración de diccionario técnico – temático
Salidas pedagógicas
Evaluación tipo ICFES
Elaboración de comics, mediante diversas plataformas
|
II
|
Hibridaciones del carbono
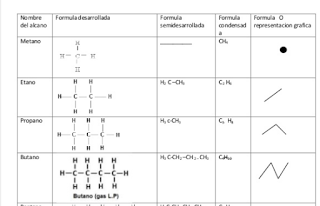
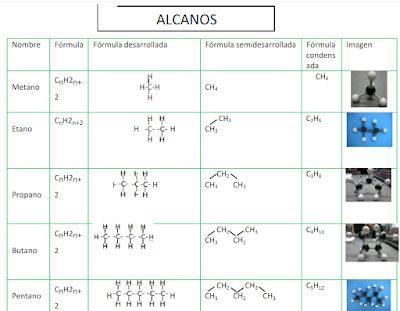
Propiedades de alcanos
Propiedades de los alquenos
Propiedades de los alquinos.
Clasificación de los hidrocarburos
Por número de átomo,
Tipo de Cadena
Grupo Funcional.
IDENTIFICACIÓN DE LAS FUNCIONES ORGÁNICAS
Alcoholes
Aldehídos
Ácidos carboxílicos
Éteres,
Aminas
Amidas.
Nomenclatura para los compuestos
orgánicos según la IUPAC
PROCESOS QUÍMICOS
Isómeros
Mecanismos de reacción
Agentes Nucleofilicos
Agentes Electrofìlicos
HIDROCARBUROS AROMÁTICOS
El benceno
Concepto
Nomenclatura
Comportamiento químico
Propiedades físicas
ALCOHOLES, FENOLES Y ÉTERES
Concepto
Clasificación
Estructura
Nomenclatura
Obtención
Propiedades físicas
|
|
III
|
ALDEHÍDOS
Y CETONAS
Concepto
Clasificación
Estructura
Nomenclatura
Comportamiento químico
Obtención
Propiedades físicas
ÁCIDOS CARBOXÍLICOS Y SUS DERIVADOS
Concepto
Clasificación
Estructura
Nomenclatura
Comportamiento químico
Obtención
Propiedades físicas.
COMPUESTOS NITROGENADOS
Aminas
Nitrilos
PROCESOS QUÍMICOS
CARBOHIDRATOS
Concepto
Isomería óptica
Carbono asimétrico
Configuraciones de isómeros ópticos
Clasificación
Monosacáridos
Disacáridos
Oligosacáridos
Polisacáridos
Importancia biológica
Propiedades físicas
|
|
LOGROS POR TRIMESTRE
CICLO
|
GRADO
|
PERIODO
|
INDICADORES DE LOGRO
|
V
|
ONCE
|
I
|
|
II
|
1.
Comprende la nomenclatura, estructura, propiedades físicas y químicas de los
hidrocarburos y aromáticos mediante comprobaciones teóricas y experimentales
2.
Comprende la nomenclatura, estructura, propiedades físicas
y químicas de los alcoholes y éteres.
3.
Reconoce los Isómeros y mecanismos de reacción de los compuestos
orgánicos, mediante la realización de los diversos ejercicios explicativos
4.
Comprende la nomenclatura, estructura, propiedades físicas y químicas de los
derivados de los alcoholes y
compuestos nitrogenados mediante comprobaciones teóricas y experimentales.
|
||
III
|
1.
Comprende la nomenclatura, estructura, propiedades físicas y químicas de los
derivados de los Aldehidos, cetonas y ácidos carboxilicos. mediante
comprobaciones teóricas y
experimentales.
2.
Comprende la nomenclatura, estructura, propiedades
físicas y químicas de Carbohidratos y lípidos, mediante la resolución de
ejercicios y su identificación a nivel
experimental
3.
Comprende la nomenclatura, estructura, propiedades
físicas y químicas de aminoácidos y proteínas, mediante la resolución de
ejercicios y prácticas experimentales.
4.
Comprende la importancia y función de las enzimas,
coenzimas y comprobando experimentalmente, evaluando las condiciones del
trabajo.
|
PRIMER TRIMESTRE
Con relación al link anterior, realizar las siguientes actividades, una vez haber realizado lectura comprensiva del texto donde se tiene en cuenta: Reconocimiento de material , clasificación y técnicas fundamentales de laboratorio.
Cada grupo de trabajo deberá realizar las actividades propuestas, contestar las preguntas, exponer una de las 9 técnicas planteadas en el texto así como entregar un informe de laboratorio una vez transcurridos 8 días de realizada la práctica.
Función del monitor: Coordinar que la exposición (con cartelera) de las técnicas de laboratorio no este repetida entre los demás grupos de trabajo, entregar el informe de laboratorio, organizar el material requerido para la práctica, en éste caso grupo No. 1.
Nota: Cada estudiante deberá tener dibujado en el cuaderno, la tabla de materiales propuesta con su bebida clasificación.
1. Reconocimiento de material
Dibujar y analizar la siguiente tabla dada así podrá clasificaros en alguna de las categorías mencionadas.
2. Clasificación
Volumétrico
Calentamiento o sostén
Equipos de medición
Equipos especiales
t 3. Técnicas fundamentales de laboratorio: Para exposición
La concentración de dióxido de nitrógeno comienza en cero y se incrementa hasta que permanece constante en la concentración de equilibrio. La concentración de tetraóxido de dinitrógeno comienza a una concentración inicial arbitraria, después disminuye hasta que alcanza la concentración de equilibrio. En el equilibrio, tanto la concentración de tetraóxido de dinitrógeno como la de dióxido de nitrógeno no varían con el tiempo.
- · Si Kc es muy grande, ~1000 o más, tendremos mayormente especies de producto presentes en el equilibrio.
- · Si Kc es muy pequeña, ~0.001 o menos, tendremos mayormente especies de reactivo presentes en el equilibrio.
- · Si Kc está entre 0.001 y 1000, tendremos una concentración significativa tanto de las especies de productos como de reactivos en el equilibrio.
¿CÓMO
CALCULAR KC A PARTIR DE LAS CONCENTRACIONES EN EL
EQUILIBRIO
Efecto de la
temperatura.
Un aumento de la temperatura causará un desplazamiento del equilibrio en el
sentido de la reacción que absorba calor, es decir, en el sentido endotérmico
de la reacción. Por el contrario, una disminución en la temperatura causará
un desplazamiento en el sentido exotérmico de la reacción.
|
Efecto de la
presión:
Si aumenta la presión, el equilibrio se desplazará hacia el lado de la
reacción donde haya menor número de moles gaseosos, contrarrestando de esta
manera la disminución de volumen. Si la presión disminuye, ocurrirá lo
contrario
|
Efecto de la
concentración: El aumento de la concentración de los reactivos causará
un desplazamiento del equilibrio hacia la formación de productos. Un aumento
en la concentración de productos determinará un desplazamiento del equilibrio
hacia la formación de reactivos. La disminución en la concentración de
reactivos o productos causa un desplazamiento hacia la formación de mayor
cantidad de reactivos o productos, respectivamente.
|
Principio de Le Chatelier, que establece lo siguiente: si
se modifica alguno de los factores capaces de alterar el equilibrio químico
(temperatura, presión, concentración) el sistema se desplazará de manera de contrarrestar la modificación.
|
ACIDOS Y BASES EN LA VIDA COTIDIANA
ACTIVIDAD


REACCIONES REDOX
QUÍMICA ORGÁNICA
https://www.youtube.com/watch?v=4BZ88ZznJRA
PARTE II
https://www.youtube.com/watch?v=N3ebV3Fw_eo
IMPORTANCIA DE LA QUÍMICA ORGÁNICA
video de apoyo
https://prezi.com/g74_jrwrza0m/la-importancia-de-la-quimica-del-carbono/
ELEMENTO CARBONO
Actividad: Realizar un mapa con las formas alotrópicas del carbono
HIBRIDACIÓN DEL CARBONO
Observa el siguiente video
Actividad: Realizar con bolas de icopor pequeñas cada hidrocarburo.
Nota: Realizar muy bien el angulo 109,5, 120° y 180°
EN RESUMEN
HIDROCARBUROS
LINK GENERAL DE CONSULTA
http://www7.uc.cl/sw_educ/educacion/grecia/plano/html/pdfs/cra/quimica/NM2/RQ2O102.pdf

COMPUESTOS ORGÁNICOS ALCANOS
prefijos y sufijos
RADICALES MAS COMUNES
Alquenos y alquinos.
Son los hidrocarburos insaturados que tienen doble enlace carbono - carbono
(alquenos) o triple enlace carbono - carbono (alquinos). Responden a las
fórmulas generales:
(CnH2n) Alquenos
(CnH2n -2) Alquinos
Nomenclatura: Las
reglas de la IUPAC para nombrar alquenos y alquinos son semejantes a las de los
alcanos, pero se deben adicionar algunas reglas para nombrar y localizar los
enlaces múltiples.
1. Para designar un doble enlace
carbono-carbono, se utiliza la terminación -eno. Cuando existen más de
un doble enlace, la terminación cambia a -dieno, -trieno y así
sucesivamente.
2. Para designar un triple enlace se utiliza
la terminación -ino (-diino para dos triples enlaces y así
sucesivamente). Los compuestos que tienen un doble y un triple enlace se llaman
-eninos.
3. Se selecciona la cadena más larga, que
incluya ambos carbonos del doble enlace. Si hay ramificaciones se toma como
cadena principal la cadena más larga de las que contienen el doble enlace
4. Numerar la cadena a partir del extremo más
cercano al enlace múltiple, de forma que los átomos de carbono de dicho enlace,
tengan los números más pequeños posibles.
Si el enlace múltiple es equidistante a ambos
extremos de la cadena la numeración empieza a partir del extremo más cercano a
la primera ramificación.
5. Indicar la posición del enlace múltiple
mediante el número del primer carbono de dicho enlace. Si se encuentran
presentes más de un enlace múltiple, numerar a partir del extremo más cercano
al primer enlace múltiple.
Si un doble y un triple enlace se encuentran
equidistantes a los extremos de la cadena, el doble enlace recibirá el número
más pequeño.
Ejemplos:
CH2 = CH2 eteno (etileno)
CH2 = CH - CH3 propeno (propileno)
CH ≡ CH etino (acetileno)
CH ≡ C - CH3 propino
A partir de cuatro carbonos, es necesario
poner un número para localizar la posición del enlace doble o triple.
Ejemplos:
CH2 = CH - CH2 - CH3 1-buteno
CH3 - CH = CH - CH3 2-buteno
CH ≡ C - CH2 - CH3 1-butino
CH3 - C≡ C - CH3 2-butino
Las ramificaciones se nombran de la forma
usual.
En los cicloalquenos y cicloalquinos, se empieza a numerar el anillo a partir de los carbonos del enlace múltiple.
Radicales
de alquenos: Hay dos
importantes radicales de alquenos que tienen nombres comunes. Son el grupo vinilo
y el grupo alilo:
CH2 = CH - Vinilo
CH2 = CH - CH2 – Alilo
Taller
ALCOHOLES
https://www.youtube.com/watch?v=gh2cAr62sjc
https://www.youtube.com/watch?v=ysNbS-M1gZE&t=118s Reactivo de lucar y triclocuro de hierro
TERCER TRIMESTRE
| Escriba en su cuaderno todo el contenido de este taller y realice los ejercicios |
| Del grupo de los aldehídos se destaca el metanal, más conocido como formaldehído, empleado como antiséptico (conservación de cadáveres) | La vainilla y la canela deben sus sabores y aromas a la presencia de aldehídos aromáticos | Las cetonas se utilizan como disolvente del esmalte de uñas y en productos farmacéuticos |
- Copie el cuadro de los principales aldehídos y complete llenando las casillas vacía
Principales aldehídos Del alcano Se forma el aldehído Fórmula semicondensada del aldehído 
metano 
metanal HCHO 
Etano 
. CH3 − CHO 
Propano 
. CH3 – CH2 − CHO .
.Butano . . . .
.Pentano . . . - ¿Qué usos tiene el metanal o formaldehido?
- ¿Qué usos tienen los aldehídos aromáticos?
- ¿Cuál es el empleo de las cetonas?
- Escriba las fórmulas semicondensadas del metanal, etanal y propanal
- Copie las fórmulas y los nombres de las siguientes cetonas:
- Escriba lo siguiente:Fíjese que las cetonas también tienen un grupo carbonilo, pero en la mitad de la cadena a diferencia de los aldehídos, que lo tienen al final de la cadena.
| Tabla 1: Ejemplos de aminoácidos |
|---|
| Note que algunos aminoácidos contienen azufre como la glutamina, otros tienen anillos de benceno como la tirosina y otros, como la metionina tienen más de un radical amino y/o ácido. |
- Atracción iónica entre los grupos R (puentes eléctricos) con cargas positivas y negativas.
- Puentes de hidrógeno entre aminoácidos de la misma cadena.
- Interacciones hidrófobas de los grupos R no polares que se desplazan hacia el centro de la estructura globular, lejos del agua circundante.
- Puentes disulfuro covalentes (- S – S -), los cuales unen los átomos de azufre de dos aminoácidos de una misma cadena o de cadenas distintas.
Los cambios en la estructura tridimensional de una proteína alteran su actividad biológica. Cuando una proteína se calienta o se trata con algunas sustancias químicas, su estructura terciaria se distorsiona y la cadena peptídica en espiral se desdobla para dar lugar a una conformación aleatoria. Este cambio en la forma de la proteína y la pérdida de su actividad biológica se denominadesnaturalización.
|
| Tabla 2: funciones biológicas de las proteínas | |
|---|---|
| función | Ejemplo |
| Función estructural | Colágeno de la piel, osteína de los huesos, miocina de los músculos |
| Función enzimática | Enzimas digestivas |
| Función hormonal | Insulina, prolactina |
| Función de transporte | Hemoglobina |
| Función homeostática | Algunas proteínas funcionan como amortiguadores, manteniendo en diversos medios tanto el pH interno como el equilibrio osmótico |
| Función de defensa inmunitaria | Anticuerpos |
| Funciones reguladoras | Histonas asociadas a la actividad del ADN |
| Función contráctil | Actina de los músculos |
| Transducción de señales (cambio en la naturaleza fisicoquímica de señales) | Como la rodopsina de la retina, que transforma una señal lumínica en un impulso nervioso. |
| Funciones de reserva energética | Albúmina del huevo que sirve de reserva para el desarrollo del embrión |
| Tabla 3: Clasificación de las proteínas | ||
|---|---|---|
| Proteínas simples | Proteínas conjugadas | |
| Fibrosas | Queratina de cabello, uñas y piel Elastina de los músculos Colágeno de la piel y ligamentos | Lipoproteínas como la HDL que transporta colesterol al hígado Glucoproteínas como la gonadotropina coriónica humana Cromoproteínas como la hemoglobina. Nucleoproteínas como las histonas |
| Globulares | Albúminas del huevo. Hormonas como la insulina Enzimas como las digestivas | |
- ¿Qué son proteínas?
- Escriba el nombre de los elementos que constituyen las proteínas
- ¿Cómo se llaman las unidades fundamentales de las proteínas y por qué reciben ese nombre?
- ¿cuántos aminoácidos forman las proteínas y por qué a algunos se les llama esenciales?
- Copie la tabla 1
- ¿Cómo obtienen los vegetales y los animales sus aminoácidos?
- ¿Qué es una cadena peptídica o polipéptido?
- Escriba la definición de la estructura primaria de las proteínas y dé un ejemplo.
- ¿Qué es la estructura secundaria de las proteínas? Nombre los dos tipos
- ¿Qué es el tipo espiral y cómo se forma? Dé ejemplos.
- ¿cuál es la diferencia entre una lámina intercatenaria y una intracatenaria?
- ¿Qué es la estructura terciaria y qué facilita esta conformación?
- Copie los cuatro factores que interaccionan entre los radicales (R) de los aminoácidos
- ¿A qué se denomina desnaturalización de una proteína?
- Copie la tabla 2
- ¿Cuál es la diferencia entre proteínas simples y conjugadas?
- ¿A qué se llama grupo prostético?
- Copie la tabla 3.
| Los ácidos orgánicos presentan como grupo funcional el carboxilo: |  |
| La fórmula general de los ácidos carboxílicos es donde R es una cadena de carbonos. |  |
| Ejemplos: | |
Para nombrar los ácidos carboxílicos se emplea la palabra ácido, luego el prefijo del alcano correspondiente al número de carbonos (met, et, prop, but, pent, etc.) y la terminación oico de manera que se tienen nombres de ácidos como ácido metanoico, ácido etanoico, ácido propanoico, ácido butanoico, ácido pentanoico, etc. Recuerda que el grupo funcional ácido solo está presente en los carbonos primarios.
|
- Complete el siguiente cuadro para saber de donde proviene cada ácido con su respectiva fórmula, así:
- En la primera columna escriba la fórmula de los cinco primeros alcanos (metano, etano, propano, butano pentano)
- En la segunda columna escriba los radicales correspondientes (metil, etil, propil, butil, pentil)
- En la tercera columna escriba las fórmulas de los ácidos que se obtienen completando el grupo carboxilo en el último carbono del radical
- En la cuarta columna escriba el nombre del ácido obtenido.
Alcano Radical Ácido Nombre del ácido CH4
MetanoCH3−
MetilÁcido metanoico CH3−CH3
Etano. . . . . . . . . ácido butanóico . CH3−CH2−CH2−CH2−CH2−
Pentil. . - ¿Qué otro nombre recibe el ácido metanoico y en qué insecto se encuentra?
- Escriba la fórmula del ácido fórmico
- ¿En qué se emplea el ácido metanoico?
- ¿Qué otro nombre recibe el ácido etanoico?
- ¿En qué se utiliza el ácido etanoico?
- ¿Cómo se nombran entonces los ácidos?
- ¿Qué forman los ácidos al reaccionar con bases o hidróxidos como el NaOH?
- Escriba la ecuación del ejemplo en la cual se forma una sal al hacer reaccionar el ácido etanoico con hidróxido de sodio.
Además se usan como antitranspirantes y como neutralizantes, tambien para fabricar detergentes biodegradables, lubricantes y espesantes para pinturas.
El ácido esteárico se emplea para combinar caucho o hule con otras sustancias, como pigmentos u otros materiales que controlen la flexibilidad de los productos derivados del caucho; también se usa en la polimerización de estireno y butadieno para hacer caucho artificial. Entre los nuevos usos de los ácidos grasos se encuentran la flotación de menas y la fabricación de desinfectantes, secadores de barniz y estabilizadores de calor para las resinas de vinilo. Los ácidos grasos se utilizan también en productos plásticos, como los recubrimientos para madera y metal, y en los automóviles, desde el alojamiento del filtro de aire hasta la tapicería.
• Ácido acetilsalicílico: conocido como aspirina y usado contra la fiebre y analgésico, es producido junto con el ácido acético, por la reacción de esterificación del ácido salicílico (2hidroxibenzoico) con el anhídrido acético (Shreve e Brink, 1980). El nombre del ácido salicílico deriva del latín del árbol de sauce, salix.
- ¿Qué es un lípido?
- ¿Qué elementos constituyen los lípidos?
- ¿Cómo están formados la mayoría de los lípidos?
- Escriba las funciones de los lípidos
- ¿Cuáles son los esteroides de importancia biológica y cómo actúan algunos de ellos?
- Copie la figura que muestra la estructura básica de los esteroides
- ¿Qué son los ácidos grasos y cómo actúan en las células?
- ¿Cómo se encuentran los ácidos grasos en el organismo?
- Nombre 2 ácidos grasos esenciales
- ¿A qué tipo de lípido pertenecen las prostaglandinas?
- ¿Qué son los glicéridos y cuáles son sus 3 clases?
- ¿Qué son triglicéridos y cómo se genera obesidad?
- Copie la figura que muestra la estructura básica de los triglicéridos
- ¿Qué diferencia entre los ácidos grasos de las grasas animales y vegetales?
- ¿Qué función cumplen los céridos? ¿Dónde se encuentran en plantas y animales? Escriba tres ejemplos
- ¿qué son terpenos y cuáles son sus fuentes?
- Nombre las vitaminas derivadas de los terpenos
- Copie la figura que muestra la estructura básica de los terpenos.
- ¿Cómo están formados los fosfolípidos y cuál es su relación con la membrana celular?
NOTA: Se activa la plataforma cualitativa una vez explicado el tema (5 min)
Nota: Realice las tablas de los ácidos grasos insaturados y saturados en su cuaderno
Ácidos grasos saturados
| |||
Nombre trivial
|
Nombre IUPAC
|
Estructura
|
Número lipídico
|
Ácido propanoico
|
CH3CH2COOH
|
C3:0
| |
Ácido butanoico
|
CH3(CH2)2COOH
|
C4:0
| |
Ácido pentanoico
|
CH3(CH2)3COOH
|
C5:0
| |
Ácido hexanoico
|
CH3(CH2)4COOH
|
C6:0
| |
Ácido heptanoico
|
CH3(CH2)5)COOH
|
C7:0
| |
Ácido octanoico
|
CH3(CH2)6COOH
|
C8:0
| |
Ácido nonanoico
|
CH3(CH2)7COOH
|
C9:0
| |
Ácido decanoico
|
CH3(CH2)8COOH
|
C10:0
| |
-
|
CH3(CH2)9COOH
|
C11:0
| |
Ácido dodecanoico
|
CH3(CH2)10COOH
|
C12:0
| |
-
|
CH3(CH2)11COOH
|
C13:0
| |
Ácido tetradecanoico
|
CH3(CH2)12COOH
|
C14:0
| |
-
|
CH3(CH2)13COOH
|
C15:0
| |
Ácido hexadecanoico
|
CH3(CH2)14COOH
|
C16:0
| |
Ácido heptadecanoico
|
CH3(CH2)15COOH
|
C17:0
| |
Ácido octadecanoico
|
CH3(CH2)16COOH
|
C18:0
| |
-
|
CH3(CH2)17COOH
|
C19:0
| |
Ácido eicosanoico
|
CH3(CH2)18COOH
|
C20:0
| |
-
|
CH3(CH2)19COOH
|
C21:0
| |
Ácido docosanoico
|
CH3(CH2)20COOH
|
C22:0
| |
-
|
CH3(CH2)21COOH
|
C23:0
| |
Ácido tetracosanoico
|
CH3(CH2)22COOH
|
C24:0
| |
CH3(CH2)23COOH
|
C25:0
| ||
Ácido hexacosanoico
|
CH3(CH2)24COOH
|
C26:0
| |
-
|
CH3(CH2)25COOH
|
C27:0
| |
Ácido octacosanoico
|
CH3(CH2)26COOH
|
C28:0
| |
-
|
CH3(CH2)27COOH
|
C29:0
| |
Ácido triacontanoico
|
CH3(CH2)28COOH
|
C30:0
| |
-
|
CH3(CH2)29COOH
|
C31:0
| |
Ácido dotriacontanoico
|
CH3(CH2)30COOH
|
C32:0
| |
Ácido tritriacontanoico
|
CH3(CH2)31COOH
|
C33:0
| |
Ácido tetratriacontanoico
|
CH3(CH2)32COOH
|
C34:0
| |
Ácido pentatriacontanoico
|
CH3(CH2)33COOH
|
C35:0
| |
Ácido hexatriacontanoico
|
CH3(CH2)34COOH
|
C36:0
| |
Ácidos grasos insaturados
| |||||
Nombre trivial
|
Estructura química
|
Δx
|
C:D
|
n−x
| |
CH3(CH2)3CH=CH(CH2)7COOH
|
cis-Δ9
|
14:1
|
n−5
| ||
CH3(CH2)5CH=CH(CH2)7COOH
|
cis-Δ9
|
16:1
|
n−7
| ||
CH3(CH2)8CH=CH(CH2)4COOH
|
cis-Δ6
|
16:1
|
n−10
| ||
CH3(CH2)7CH=CH(CH2)7COOH
|
cis-Δ9
|
18:1
| |||
CH3(CH2)7CH=CH(CH2)7COOH
|
trans-Δ9
|
18:1
| |||
CH3(CH2)5CH=CH(CH2)9COOH
|
trans-Δ11
|
18:1
|
n−7
| ||
CH3(CH2)4CH=CHCH2CH=CH(CH2)7COOH
|
cis,cis-Δ9,Δ12
|
18:2
| |||
CH3(CH2)4CH=CHCH2CH=CH(CH2)7COOH
|
trans,trans-Δ9,Δ12
|
18:2
| |||
CH3CH2CH=CHCH2CH=CHCH2CH=CH(CH2)7COOH
|
cis,cis,cis-Δ9,Δ12,Δ15
|
18:3
| |||
CH3(CH2)4CH=CHCH2CH=CHCH2CH=CH(CH2)4COOH
|
cis,cis,cis-Δ6,Δ9,Δ12
|
18:3
| |||
CH3(CH2)3CH=CH-CH=CH-CH=CH(CH2)7COOH
|
cis,trans,cis-Δ9,Δ11,Δ13
|
18:3
|
n−5
| ||
cis,cis,cis,cis-Δ5Δ8,Δ11,Δ14
|
20:4
| ||||
CH3CH2CH=CHCH2CH=CHCH2CH=CHCH2CH=CHCH2CH=CH(CH2)3COOH
|
cis,cis,cis,cis,cis-Δ5,Δ8,Δ11,Δ14,Δ17
|
20:5
| |||
CH3(CH2)7CH=CH(CH2)11COOH
|
cis-Δ13
|
22:1
| |||
CH3CH2CH=CHCH2CH=CHCH2CH=CHCH2CH=CHCH2CH=CHCH2CH=CH(CH2)2COOH
|
cis,cis,cis,cis,cis,cis-Δ4,Δ7,Δ10,Δ13,Δ16,Δ19
|
22:6
| |||
*********************************************************************************
Conteste las siguientes preguntas en su cuaderno y entre a la pagina virtual Socrative y escriba sus respuestas en linea.
1. Cuales son las drogas que han llevado a los deportistas a tratar de mejorar sus condiciones de manera artificial?
2. ¿Cómo actúan las anfetaminas?
3. ¿En que se usan actualmente las anfetaminas?
4. ¿Que ocurre con el consumo de altas dosis de anfetaminas?
5. ¿Que dosis de anfetaminas pueden causar la muerte?
6. ¿Que efectos y acciones tiene la efedrina?
7. ¿Que ocasiona en los deportistas el uso de estimulantes?
8. ¿Para que se utiliza la efedrina en medicina?



































































.jpg)
.jpg)
.jpg)









No hay comentarios:
Publicar un comentario