ÁREA DE CIENCIAS NATURALES
Y EDUCACIÓN AMBIENTAL
CICLO
V
JORNADA
MAÑANA
INDICADORES
DE LOGRO 2022
ACTIVIDAD: Consignar en el cuaderno los estándares institucionales así como los "Estándares básicos de competencia EBC y Derechos básicos de aprendizaje DBA
CICLO
|
GRADO
|
TRIMESTRE
|
ESTÁNDAR INSTITUCIONAL
|
v |
DÉCIMO |
I
|
1. ESTÁNDAR INSTITUCIONAL:
Establece la estructura del átomo con la relación de la distribución de los electrones y su comportamiento químico.
EBC: Explico la estructura de los átomos a partir de diferentes teorías.
2. ESTÁNDAR INSTITUCIONAL: Identifica las características de las diferentes sustancias, así como de los métodos de separación de mezclas.
EBC: Explico la relación entre la estructura de los átomos y los enlaces
que realiza.
3. ESTÁNDAR INSTITUCIONAL:
Utiliza la
nomenclatura propuesta por la Unión Internacional de Química Pura y Aplicada
(IUPAC) Para nombrar los (óxidos,
ácidos, hidróxidos, sales)
EBC: Uso la tabla periódica para determinar propiedades físicas y químicas
de los elementos.
|
ACTIVIDAD: Consultar una de las plataformas expuestas a continuación realizando un paso a pago en un octavo de cartulina, para exponer.
PLATAFORMAS
Socrative
Kahoot
Pixton
Classtool.net
Educaplay
Powtoon.com
Classroom (Tener un correo electronico con todo su nombre Ej maritzamayorlopez@gmail.com)
Paycanuas
Stency
Goanimate
Socrative
Kahoot
Pixton
Classtool.net
Educaplay
Powtoon.com
Classroom (Tener un correo electronico con todo su nombre Ej maritzamayorlopez@gmail.com)
Paycanuas
Stency
Goanimate
LOGROS PRIMER TRIMESTRE
1. ESTÁNDAR INSTITUCIONAL:
Establece la estructura del átomo con la relación de la distribución de los electrones y comportamiento químico.
2. ESTÁNDAR INSTITUCIONAL:
Identifica las características de las diferentes sustancias, así como de los métodos de separación de mezclas.
3. ESTÁNDAR INSTITUCIONAL
Establece la estructura del átomo con la relación de la distribución de los electrones y comportamiento químico.
2. ESTÁNDAR INSTITUCIONAL:
Identifica las características de las diferentes sustancias, así como de los métodos de separación de mezclas.
3. ESTÁNDAR INSTITUCIONAL
Utiliza la nomenclatura propuesta por la Unión Internacional de Química Pura y Aplicada (IUPAC) Para nombrar los (óxidos, ácidos, hidróxidos, sales)
HABILIDADES Y COMPETENCIAS:
Explica la composición de la materia (átomos y moléculas) de las sustancias a partir de unos modelos discontinuos de la materia.
MATERIA
Masa
Sustancias puras
Tipos de materia
Mezclas
Mezcla homogénea
Mezcla heterogénea
Estados de la materia
Cambios de estado
Cambios químicos
Métodos de separación de mezclas
Propiedades de la materia (intensivas – Extensivas)
Establece relaciones acerca del proceso evolutivo de la química
LOGRO ACTITUDINALES:
Entiendo la importancia de mantener expresiones de afecto y cuidado mutuo con mis familiares, amigos, amigas y pareja, a pesar de las diferencias, disgustos o conflictos
Escucho e interpreto las ideas de otros en una situación dada y sustento los posibles desacuerdos con argumentos propios
Utilización de los tics: A través de consultas vía internet se documenta para complementar los conceptos
Diferencia los modelos atómicos y argumenta su validez de acuerdo con los postulados de cada uno.
ESTRUCTURA ATÓMICA
Numero atómico
Peso atómico
Peso Molecular
Mol
Envoltura ó corteza
Números cuánticos
Distribución electrónica
Modelo atómico actual
Formula en lenguaje científico conversiones
Reconoce y explica las propiedades de la materia
Entiendo la importancia de mantener expresiones de afecto y cuidado mutuo con mis familiares, amigos, amigas y pareja, a pesar de las diferencias, disgustos o conflictos
Escucho e interpreto las ideas de otros en una situación dada y sustento los posibles desacuerdos con argumentos propios.
Utilización de los tics: A través de consultas vía Internet se documenta para complementar los conceptos.
Deduce las formulas químicas a partir de la composición porcentual, pues establece diferencias entre la relación mínima y el número exacto de átomos de los elementos que constituyen un compuesto.
Analiza y explica la variación de radio atómico, energía de ionización, afinidad electrónica y electronegatividad de los elementos químicos, luego de deducir sus propiedades de acuerdo con la ubicación en la tabla periódica.
Numero atómico
Peso atómico
Peso Molecular
Mol
Envoltura ó corteza
Números cuánticos
Distribución electrónica
Modelo atómico actual
Formula en lenguaje científico conversiones
Reconoce y explica las propiedades de la materia
Entiendo la importancia de mantener expresiones de afecto y cuidado mutuo con mis familiares, amigos, amigas y pareja, a pesar de las diferencias, disgustos o conflictos
Escucho e interpreto las ideas de otros en una situación dada y sustento los posibles desacuerdos con argumentos propios.
Utilización de los tics: A través de consultas vía Internet se documenta para complementar los conceptos.
Deduce las formulas químicas a partir de la composición porcentual, pues establece diferencias entre la relación mínima y el número exacto de átomos de los elementos que constituyen un compuesto.
Analiza y explica la variación de radio atómico, energía de ionización, afinidad electrónica y electronegatividad de los elementos químicos, luego de deducir sus propiedades de acuerdo con la ubicación en la tabla periódica.
FORMULAS QUÍMICAS
Elaboración
tipos de formulas
Empírica
Molecular
Electrónica
Estructural
NOMENCLATURA
Nomenclatura y funcionen químicas
Función oxido
Función hidróxido
Función ácido
Función Sal
TIPOS DE SALES
ACTITUDES:
Reconoce los alcances y las limitaciones de las teorías atómicas.
Reconoce las propiedades periódicas y su importancia
Establece las normas que se aplican en la nomenclatura química
Identifico y supero emociones, como el resentimiento y el odio, para poder perdonar y reconciliarme con quienes he tenido conflicto.
CRECIMIENTO PERSONAL
Identifico dilemas de la vida, en los que distintos derechos o valores entran en conflicto y analizo posibles opciones de solución, considerando los aspectos positivos y negativos de cada una.
Identifico las necesidades de cambio de una situación dada y establezco nuevas rutas de acción que conduzcan a la solución de un problema.
Identifico problemas en una situación dada, analizó formas para superarlos e implemento la alternativa más adecuada.
Protección y conservación del medio ambiente: Al reconocer los factores que intervienen en un ecosistema asume una posición de defensa para mejorar el medio ambiente.
ESTRATEGIA APRENDE EN CASA
PLAN DE MEJORAMIENTO
I TRIMESTRE CON VIRTUALIDAD.
PLAN DE MEJORAMIENTO PRIMER TRIMESTRE
(este no)
Con relación al link anterior, realizar las siguientes actividades, una vez haber realizado lectura comprensiva del texto donde se tiene en cuenta: Reconocimiento de material , clasificación y técnicas fundamentales de laboratorio.
Cada grupo de trabajo deberá realizar las actividades propuestas, contestar las preguntas, exponer una de las 9 técnicas planteadas en el texto así como entregar un informe de laboratorio una vez transcurridos 8 días de realizada la práctica.
Función del monitor: Coordinar que la exposición (con cartelera) de las técnicas de laboratorio no este repetida entre los demás grupos de trabajo, entregar el informe de laboratorio, organizar el material requerido para la práctica, en éste caso grupo No. 1.
Nota: Cada estudiante deberá tener dibujado en el cuaderno, la tabla de materiales propuesta con su debida clasificación.
1. Reconocimiento de material
Dibujar y analizar la siguiente tabla dada así podrá clasificaros en alguna de las categorías mencionadas.
2. Clasificación
Volumétrico
Calentamiento o sostén
Equipos de medición
Equipos especiales
3. Técnicas fundamentales de laboratorio: Para exposición
ACTIVIDAD No. 2
Realice lectura comprensiva del siguiente mapa conceptual sobre materia y propiedades de la materia.
Grafíquelo en su cuaderno (utilice la plataforma Classtool.net) y realiza una espina de pescado) y busque con ayuda de la tableta los conceptos claves.
DESARROLLO DE CONTENIDOS
TAREA: Consultar que son propiedades intensivas y extensivas, definirlas y dar un ejemplo
LEYES PONDERALES
Control No. 1 Tema: Materia
Cero Rankine (0 R) equivalen a −273,15 °C o 0 K. Para convertir de grados Rankine a Kelvin se multiplica por un factor de 9/5:
ACTIVIDAD No. 4 EJERCICIOS DE TEMPERATURA.
ACTIVIDAD No. 8: Definir cada uno de los estados de agregación, con su respectivo dibujo en el cuaderno de química.
ACTIVIDAD No 9
RECONOCIMIENTO DE LOS MATERIALES DE LABORATORIO
(PRACTICA No. 1)
Link de consulta:
http://www.ing.unp.edu.ar/asignaturas/quimica/practicos_de_laboratorio_pdf/lab1.pdf
QUIZ
Favor ingresar a la plataforma Socrative, no olvidar la sala de llama aula virtual 2015. Alli encontrará el cuestionario habilitado, el día y la hora establecida.
CLASES DE MATERIA
ACTIVIDAD No. 10. Realizar un mapa conceptual sobre el tema de mezclas y tipos de mezclas, dibuja y ejemplo y realiza el mapa conceptual en su cuaderno
MEZCLAS HOMOGÉNEAS Y HETEROGÉNEAS
Objetivos
Preparar y separar mezclas según la naturaleza de sus componentes
Identificar los procesos de separación de mezclas
Materiales y Reactivos:
Vaso de precipitado de 100, 250, 400 mL
Embudo tallo largo
Papel de filtro
Vidrio reloj
Cápsula de evaporación
Embudo de separación
Balanza de un plato
Cilindro graduado de 10 y 50 mL
Balones aforados de 100 y 250 mL
Pipeta volumétrica de 5 mL
Pipeta graduada de 5, 10 mL
Agitadores
Colador
Arena
Sal
Aceite vegetal
Agua
NaCl.
Limaduras de hierro
Harina
Lentejas
Introducción
En la fabricación de medicinas, alimentos y otros productos químicos la pureza de las sustancias es esencial. La pureza es una de las ideas mas antiguas y recurrentes; pues el grado de pureza de una sustancia y su determinación es fundamental. En el laboratorio es necesario - la mayoría de las veces- trabajar con sustancias puras, para que alguna impureza no interfiera en el experimento planeado. Obtener sustancias puras significa haber eliminado otras sustancias, al separarlas de la primera.
Para lograr una separación se aprovecha el hecho de que los diversos componentes de una mezcla tiene diferentes propiedades físicas y químicas. En general, una separación es la operación por la cual una mezcla se divide en al menos dos fracciones de diferente composición.
Las principales técnicas de separación basadas en las diferencias de las propiedades de los componentes de las mezclas se muestran en la siguiente tabla:
TÉCNICAS DE SEPARACIÓN
1. Fltración
2. Destilación
3. Sublimación
4. Extracción
5. Cristalización
6. Cromatografía
PRINCIPIO
1. Baja solubilidad
2. Diferencia Punto de ebullición
3. Diferencia Punto de sublimación
4. Diferencia. de solubilidad en dos disolventes inmiscibles
5. Diferencia de solubilidad en dos disolventes fríos y calientes
6. Diferencia Movilidad de una sustancia que migra a través de un soporte.
ACTIVIDAD
Organizar el grupo de clase en 6 grupos y el profesor asignará a cada grupo de estudiantes un experimento que deberá realizar y explicar a los demas compañeros con la ayuda del docente.
Identifico dilemas de la vida, en los que distintos derechos o valores entran en conflicto y analizo posibles opciones de solución, considerando los aspectos positivos y negativos de cada una.
Identifico las necesidades de cambio de una situación dada y establezco nuevas rutas de acción que conduzcan a la solución de un problema.
Identifico problemas en una situación dada, analizó formas para superarlos e implemento la alternativa más adecuada.
Protección y conservación del medio ambiente: Al reconocer los factores que intervienen en un ecosistema asume una posición de defensa para mejorar el medio ambiente.
ESTRATEGIA APRENDE EN CASA
PLAN DE MEJORAMIENTO
I TRIMESTRE CON VIRTUALIDAD.
Propósito de la actividad de mejoramiento
|
Actividad de mejoramiento y recuperación
|
Acciones de acompañamiento docente
|
Tiempos y recursos a utilizar por parte del estudiante
|
Afianzar el concepto de mezclas, así como sus métodos
de separación.
Conocer la nomenclatura para nombrar los (óxidos, ácidos, hidróxidos, sales)
|
Realizar las actividades No. 10 y 11 de blog: Aulavirtualcolegiomoralbaciencias. No. 10. Realizar un mapa conceptual sobre el tema de mezclas y tipos de mezclas, dibuja un ejemplo. No. 11. Define y dibuja cada método de separación de mezclas.
Observar los siguientes videos, saque
las ideas principales de cada video y realice la actividad indicada.
Oxidos:
Jonnathan Baez. Realizar la actividad No. 24 de blog: Aulavirtualcolegiomoralbaciencias.
Hidroxidos:
Jonnathan Baez. Realizar la actividad No. 26 de blog: Aulavirtualcolegiomoralbaciencias.
Acidos:
Jonnathan Baez. Realizar la actividad No. 27 de blog: Aulavirtualcolegiomoralbaciencias.
Enviar fotos únicamente de las actividades resueltas
|
Asesoría por la plataforma Hangouts.
Utilización de blog de la
asignatura y explicaciones en el mismo blog.
|
Tiempo 4 horas
|
PLAN DE MEJORAMIENTO PRIMER TRIMESTRE
(este no)
Teniendo en cuenta los
resultados éste trimestre académico, para aquellos estudiantes que presentan
dificultades para alcanzar los logros propuestos se proponen las siguientes
acciones y actividades de recuperación. Las cuales se desarrollarán en la
semana de recuperación.
Logros con
dificultades para ser alcanzado
|
Actividades y
acciones para mejoramiento y recuperación
|
Establece la estructura del átomo con la relación de la distribución de los electrones y comportamiento químico.
Identifica las características de las diferentes sustancias, así como de los métodos de separación de mezclas.
Utiliza la nomenclatura propuesta por la Unión Internacional de Química Pura y Aplicada (IUPAC) Para nombrar los (óxidos, ácidos, hidróxidos, sales). |
Presentar
su cuaderno de química con apuntes y ejercicios propuestos a día.
Según
el material enviado por la plataforma
classroom sobre “Modelos atómicos”,
realizar una presentación en prezzi o power point. Agregar imágenes de los científicos y devolverla
por la plataforma para su evaluación y sustentación.
Entrega
de los dibujos de los 50 instrumentos de laboratorio,
debidamente clasificados, con su respectiva función.
Resolver del taller teórico práctico sobre "Métodos de separación de mezclas, Enlace químico y nomenclatura" que se encuentra en el blog.
Sustentación
oral ó Evaluación por la plataforma de
cada tema en referencia.
|
PRÁCTICA DE LABORATORIO No. 1
http://www.ing.unp.edu.ar/asignaturas/quimica/practicos_de_laboratorio_pdf/lab1.pdf
ACTIVIDAD No. 1
Con relación al link anterior, realizar las siguientes actividades, una vez haber realizado lectura comprensiva del texto donde se tiene en cuenta: Reconocimiento de material , clasificación y técnicas fundamentales de laboratorio.
Cada grupo de trabajo deberá realizar las actividades propuestas, contestar las preguntas, exponer una de las 9 técnicas planteadas en el texto así como entregar un informe de laboratorio una vez transcurridos 8 días de realizada la práctica.
Función del monitor: Coordinar que la exposición (con cartelera) de las técnicas de laboratorio no este repetida entre los demás grupos de trabajo, entregar el informe de laboratorio, organizar el material requerido para la práctica, en éste caso grupo No. 1.
Nota: Cada estudiante deberá tener dibujado en el cuaderno, la tabla de materiales propuesta con su debida clasificación.
1. Reconocimiento de material
Dibujar y analizar la siguiente tabla dada así podrá clasificaros en alguna de las categorías mencionadas.
2. Clasificación
Volumétrico
Calentamiento o sostén
Equipos de medición
Equipos especiales
3. Técnicas fundamentales de laboratorio: Para exposición
GRUPO Y TEMA
1. Orden Y Uso De Los Reactivos
1. Orden Y Uso De Los Reactivos
2. Manejo Del Tubo De Ensayo
3. Manejo Del Mechero De Gas
4. Balanza
5. Material De Vidrio
6. Manejo De Drogas
7. Lectura De Volúmenes
8. Medición Con Pipeta
9. Medición
Con Probeta
ACTIVIDAD No. 2
Realice lectura comprensiva del siguiente mapa conceptual sobre materia y propiedades de la materia.
Grafíquelo en su cuaderno (utilice la plataforma Classtool.net) y realiza una espina de pescado) y busque con ayuda de la tableta los conceptos claves.
DESARROLLO DE CONTENIDOS
ALGUNOS CONCEPTOS CLAVES
MATERIA: Es todo lo que tiene masa y ocupa un espacio. la masa es una medida de la cantidad de materia en una muestra de cualquier material.
ENERGIA: Se define como la capacidad de realizar trabajo o transferir calor. estamos familiarizados con muchas formas de energía como: energía mecánica, energía luminosa, energía eléctrica y energía calorífica. la energía puede clasificarse en dos tipos principales: energía cinética y energía potencial.
ENERGIA: Se define como la capacidad de realizar trabajo o transferir calor. estamos familiarizados con muchas formas de energía como: energía mecánica, energía luminosa, energía eléctrica y energía calorífica. la energía puede clasificarse en dos tipos principales: energía cinética y energía potencial.
PROPIEDADES GENERALES:
Son las propiedades que presenta todo cuerpo material sin excepción y al margen de su estado físico, así tenemos:
Masa: Es la cantidad de materia contenida en un volumen cualquiera, la masa de un cuerpo es la misma en cualquier parte de la Tierra o en otro planeta.
Volumen: Un cuerpo ocupa un lugar en el espacio
Peso: Es la acción de la gravedad de la Tierra sobre los cuerpos. En los lugares donde la fuerza de gravedad es menor, por ejemplo, en una montaña o en la Luna, el peso de los cuerpos disminuye.
Divisibilidad: Es la propiedad que tiene cualquier cuerpo de poder dividirse en pedazos más pequeños, hasta llegar a las moléculas y los átomos.
Porosidad: Como los cuerpos están formados por partículas diminutas, éstas dejan entre sí espacios vacíos llamados poros.
La inercia: Es una propiedad por la que todos los cuerpos tienden a mantenerse en su estado de reposo o movimiento.
La impenetrabilidad: Es la imposibilidad de que dos cuerpos distintos ocupen el mismo espacio simultáneamente.
La movilidad: Es la capacidad que tiene un cuerpo de cambiar su posición como consecuencia de su interacción con otros.
Elasticidad: Propiedad que tienen los cuerpos de cambiar su forma cuando se les aplica una fuerza adecuada y de recobrar la forma original cuando se suspende la acción de la fuerza. La elasticidad tiene un límite, si se sobrepasa el cuerpo sufre una deformación permanente o se rompe. Hay cuerpos especiales en los cuales se nota esta propiedad, como en una liga, en la hoja de un cuchillo; en otros, la elasticidad se manifiesta poco, como en el vidrio o en la porcelana.
PROPIEDADES ESPECIFICAS:
Son las propiedades peculiares que caracterizan a cada sustancia, permiten su diferenciación con otra y su identificación.
Entre estas propiedades tenemos: densidad, punto de ebullición, punto de fusión, índice de refracción de luz, dureza, tenacidad, ductibilidad, maleabilidad, solubilidad, reactividad, actividad óptica, energía de ionización, electronegatividad, acidez, basicidad, calor latente de fusión, calor latente de evaporización, etc.
Las propiedades especificas pueden ser químicas o físicas dependiendo si se manifiestan con o sin alteración en su composición interna o molecular.
1. Propiedades Físicas: Son aquellas propiedades que impresionan nuestros sentidos sin alterar su composición interna o molecular.
Ejemplos: densidad, estado físico (solido, liquido, gaseoso), propiedades organolépticas (color, olor, sabor), temperatura de ebullición, punto de fusion, solubilidad, dureza, conductividad eléctrica, conductividad calorífica, calor latente de fusión, etc.
A su vez las propiedades físicas pueden ser extensivas o intensivas.
Propiedades Extensivas: el valor medido de estas propiedades depende de la masa. Por ejemplo: inercia, peso, área, volumen, presión de gas, calor ganado y perdido, etc.
Propiedades Intensivas: el valor medido de estas propiedades no depende de la masa. Por ejemplo: densidad, temperatura de ebullición, color, olor, sabor, calor latente de fusión, reactividad, energía de ionización, electronegatividad, molécula gramo, átomo gramo, equivalente gramo, etc.
2. Propiedades Químicas: son aquellas propiedades que se manifiestan al alterar su estructura interna o molecular, cuando interactúan con otras sustancias.
Ejemplos: El Fe se oxida a temperatura ambiental y el Oro no se oxida; el CH4 es combustible y el CCl4 no es combustible; el Sodio reacciona violentamente con el agua fria para formar Hidróxido de Sodio y el Calcio reacciona muy lentamente con el agua para formar Hidróxido de Calcio; el alcohol es inflamable y el H2O no lo es; el acido sulfúrico quema la piel y el acido nítrico no, etc.
Resumiendo, las propiedades químicas de la materia son:
Reactividad Química
Combustión
Oxidación
Son las propiedades que presenta todo cuerpo material sin excepción y al margen de su estado físico, así tenemos:
Masa: Es la cantidad de materia contenida en un volumen cualquiera, la masa de un cuerpo es la misma en cualquier parte de la Tierra o en otro planeta.
Volumen: Un cuerpo ocupa un lugar en el espacio
Peso: Es la acción de la gravedad de la Tierra sobre los cuerpos. En los lugares donde la fuerza de gravedad es menor, por ejemplo, en una montaña o en la Luna, el peso de los cuerpos disminuye.
Divisibilidad: Es la propiedad que tiene cualquier cuerpo de poder dividirse en pedazos más pequeños, hasta llegar a las moléculas y los átomos.
Porosidad: Como los cuerpos están formados por partículas diminutas, éstas dejan entre sí espacios vacíos llamados poros.
La inercia: Es una propiedad por la que todos los cuerpos tienden a mantenerse en su estado de reposo o movimiento.
La impenetrabilidad: Es la imposibilidad de que dos cuerpos distintos ocupen el mismo espacio simultáneamente.
La movilidad: Es la capacidad que tiene un cuerpo de cambiar su posición como consecuencia de su interacción con otros.
Elasticidad: Propiedad que tienen los cuerpos de cambiar su forma cuando se les aplica una fuerza adecuada y de recobrar la forma original cuando se suspende la acción de la fuerza. La elasticidad tiene un límite, si se sobrepasa el cuerpo sufre una deformación permanente o se rompe. Hay cuerpos especiales en los cuales se nota esta propiedad, como en una liga, en la hoja de un cuchillo; en otros, la elasticidad se manifiesta poco, como en el vidrio o en la porcelana.
PROPIEDADES ESPECIFICAS:
Son las propiedades peculiares que caracterizan a cada sustancia, permiten su diferenciación con otra y su identificación.
Entre estas propiedades tenemos: densidad, punto de ebullición, punto de fusión, índice de refracción de luz, dureza, tenacidad, ductibilidad, maleabilidad, solubilidad, reactividad, actividad óptica, energía de ionización, electronegatividad, acidez, basicidad, calor latente de fusión, calor latente de evaporización, etc.
Las propiedades especificas pueden ser químicas o físicas dependiendo si se manifiestan con o sin alteración en su composición interna o molecular.
1. Propiedades Físicas: Son aquellas propiedades que impresionan nuestros sentidos sin alterar su composición interna o molecular.
Ejemplos: densidad, estado físico (solido, liquido, gaseoso), propiedades organolépticas (color, olor, sabor), temperatura de ebullición, punto de fusion, solubilidad, dureza, conductividad eléctrica, conductividad calorífica, calor latente de fusión, etc.
A su vez las propiedades físicas pueden ser extensivas o intensivas.
Propiedades Extensivas: el valor medido de estas propiedades depende de la masa. Por ejemplo: inercia, peso, área, volumen, presión de gas, calor ganado y perdido, etc.
Propiedades Intensivas: el valor medido de estas propiedades no depende de la masa. Por ejemplo: densidad, temperatura de ebullición, color, olor, sabor, calor latente de fusión, reactividad, energía de ionización, electronegatividad, molécula gramo, átomo gramo, equivalente gramo, etc.
2. Propiedades Químicas: son aquellas propiedades que se manifiestan al alterar su estructura interna o molecular, cuando interactúan con otras sustancias.
Ejemplos: El Fe se oxida a temperatura ambiental y el Oro no se oxida; el CH4 es combustible y el CCl4 no es combustible; el Sodio reacciona violentamente con el agua fria para formar Hidróxido de Sodio y el Calcio reacciona muy lentamente con el agua para formar Hidróxido de Calcio; el alcohol es inflamable y el H2O no lo es; el acido sulfúrico quema la piel y el acido nítrico no, etc.
Resumiendo, las propiedades químicas de la materia son:
Reactividad Química
Combustión
Oxidación
OTROS CONCEPTOS CLAVES
Punto de ebullición:
es la temperatura a la cual una sustancia pasa del estado líquido al estado
gaseoso.
Punto de fusión:
es la temperatura a la cual una sustancia pasa del estado sólido al estado
líquido.
Solubilidad: es
la propiedad que tienen algunas sustancias de disolverse en un líquido a una
temperatura determinada.
Densidad: es la
relación que existe entre la masa de una sustancia y su volumen.
Dureza: es la
resistencia que oponen las sustancias a ser rayadas. Se mide mediante una
escala denominada escala de Mohs que va de uno hasta diez. Así, por ejemplo,
dentro de esta escala el talco tiene una dureza de uno (1), mientras que el
diamante presenta un grado de dureza de diez (10).
Elasticidad: es
la capacidad que tienen los cuerpos de deformarse cuando se aplica una fuerza
sobre ellos y de recuperar su forma original cuando la fuerza aplicada se
suprime.
Ductilidad: mide el
grado de facilidad con que ciertos materiales se dejan convertir en alambres o
hilos.
Maleabilidad:
mide la capacidad que tienen ciertos materiales para convertirse en láminas. En
general, los materiales que son dúctiles también son maleables.
Tenacidad: es la
resistencia que ofrecen los cuerpos a romperse o deformarse cuando se les
golpea. Uno de los materiales más tenaces es el acero.
Fragilidad: es la
tendencia a romperse o fracturarse.
TAREA: Consultar que son propiedades intensivas y extensivas, definirlas y dar un ejemplo
LEYES PONDERALES
Las leyes ponderales son
aquellas que rigen el comportamiento de la materia en los cambios químicos, en
función de la masa de las sustancias que participan.
Ley
de la Conservación de la Masa
Respaldada por el trabajo
del científico Antoine Lavoisier, esta ley sostiene que la materia (la masa) no
puede crearse o destruirse durante una reacción química, sino solo
transformarse o sufrir cambios de forma.
Es decir, que la cantidad de materia al inicio y al final de una
reacción permanece constante
“En las reacciones químicas,
la cantidad de materia que interviene permanece constante”
Ejemplo:
32g de azufre se calientan
con 56g de hierro, formando como producto único el sulfuro ferroso. ¿Qué cantidad de producto se obtiene de esta
reacción?
Solución:
De acuerdo a la ley de la
conservación de la masa, la masa de los reactantes debe ser igual a la masa de
los productos. Por lo tanto, si 88g de
reactantes (32g + 56g) se combinaron al inicio de la reacción, la misma
cantidad de masa debe obtenerse en los productos. Dado que el único producto es el sulfato
ferroso, la cantidad de éste obtenida debe ser de 88g.
Ley
de las Proporciones Definidas o Constantes
Enunciada por el científico
Proust, esta ley mantiene que al combinarse dos o mas elementos para hacer un
compuesto determinado, las masas de las sustancias que intervienen son
fijas. Es decir, que existe una proporción
de combinación exacta e invariable y por lo tanto, la composición de un compuesto específico
siempre es la misma. Por ejemplo, en la
formación del agua (H2O) intervienen dos átomos de hidrógeno y uno de oxígeno. Relacionando sus masas, la proporción de H a
O es de 1g de H por cada 8g de O. Si
reaccionan 2g de H, se combinarán con 16g de O para formar el mismo
compuesto. Así mismo, si intervienen 4g
de H en la formación de agua, la cantidad de O será de 32g. La proporción 1g H : 8g O es constante para
cualquier muestra de agua, un compuesto determinado. Si la proporción llegara a cambiar, se puede
concluir que el compuesto no es el mismo y que se trata de otro compuesto
diferente que contiene los mismos elementos.
“En la formación de un
compuesto, la cantidad de un elemento que se combina con una masa definida de
otro es siempre la misma”.
Ejemplo
Una muestra de 100. g de
óxido de mercurio (II) contiene 92.6g de mercurio y 7.40 g de oxígeno. ¿Cuánto oxigeno se encuentra en otra muestra
del mismo compuesto que contiene 150. g de mercurio?
Solución:
Según la ley de las
proporciones definidas o constantes, la proporción de mercurio a oxígeno en el
óxido de mercurio (II) es constante. La
proporción es de 92.6g Hg/7.40g O = 12.5g.
Es decir que por cada gramo de oxígeno en el compuesto, hay 12.5g de
mercurio. Si la muestra contiene 150.g
de Hg, la cantidad de O es de 150./12.5 = 12.0 Por lo tanto, hay 12.0 g de
oxígeno en la muestra.
Ley
de las Proporciones Múltiples
Afirmada por el trabajo
científico de John Dalton, esta ley se aplica a compuestos diferentes que se
conforman de los mismos elementos. La
ley afirma que cuando existe la combinación de elementos en más de una
proporción para formar diferentes compuestos, la relación entre las masas de
uno de los elementos que reacciona con una misma masa de otro elemento se
expresa en números enteros pequeños.
Por ejemplo, el carbono y
el oxígeno forman dos compuestos comunes
que son el dióxido de carbono (CO2) y el monóxido de carbono (CO).
Compuesto
|
Relación por masa molar
|
Proporción
|
CO2
|
12g C: 32g O
|
1:2
|
CO
|
12g C: 16g O
|
1:1
|
Control No. 1 Tema: Materia
Favor ingresar a la plataforma Socrative, no olvidar la sala de llama aula virtual 2015. Allí encontrará el cuestionario habilitado, el día y la hora establecida.
3. ACTIVIDAD No. 3
Acerca del tema Temperatura, realizar resumen en el cuaderno, dibujar las escalas y realizar los ejercicios propuestos.
Acerca del tema Temperatura, realizar resumen en el cuaderno, dibujar las escalas y realizar los ejercicios propuestos.
TEMPERATURA.
Para medir la temperatura de
un cuerpo se emplea el termómetro que es un dispositivo que al ponerse en
contacto con el cuerpo recoge el calor desprendido por éste. Dicho calor
produce un cambio en alguna de las partes del termómetro, cambio que se puede observar
y medir fácilmente. Por ejemplo, en el termómetro de mercurio, el cambio
producido es la dilatación de dicho metal dentro de un tubo capilar; mientras
mayor sea la temperatura mayor será la dilatación producida. Si la temperatura
disminuye, el mercurio se contrae y la columna de mercurio desciende. Así pues,
si se marca una escala en la parte externa del termómetro, la altura de la columna
de mercurio, leída sobre dicha escala, nos da una medida de la temperatura.
En orden a definir una
escala de temperatura es necesario establecer como mínimo dos puntos de referencia,
que se marcan en el termómetro. La distancia entre estos dos puntos se divide
en un número determinado de grados, lo que determina el tamaño de cada grado.
Los puntos de referencia corrientes son las temperaturas de congelación y de
ebullición del agua.
LA ESCALA CELSIUS, °C
La escala más común entre
nosotros es la Celsius, familiar mente denominada escala centígrada. En esta
escala, los valores de referencia son O y 100 para las temperaturas de
congelación y de ebullición del agua, respectivamente. De esta manera, un grado
Celsius o centígrado, °C, es la centésima parte de la diferencia de temperatura
que existe entre los puntos de congelación y de ebullición del agua.
Temperaturas inferiores a la
del punto de congelación del agua se expresan en esta escala por medio de
valores negativos. Así, oímos decir que la temperatura de determinada región
descendió a diez grados bajo cero, lo que corresponde a -10°C.
°C = 5/9 (°F-
32)
LA ESCALA KELVIN, K
Como veremos más adelante,
existen razones teóricas que conducen a pensar que -273,15°C es la mínima
temperatura que puede llegar a alcanzarse. Esta temperatura, -273,15°C, se
denomina, por tanto, cero absoluto y se utiliza para establecer otra escala de temperaturas,
conocida como escala Kelvin. La escala Kelvin es la aceptada en el Sistema Internacional
de unidades y se emplea frecuentemente en el trabajo científico. En esta
escala, la temperatura se expresa en kelvins (no en grados Kelvin), los cuales
se simbolizan por la letra K (no °K). El tamaño de un kelvin es igual al de un
grado centígrado, de tal manera que el punto de congelación del agua es 273,15
K y el de ebullición, de 373,15 K. Matemáticamente:
K = °C + 273
C° = °K - 273
LA ESCALA FAHRENHEIT, °F
En el sistema inglés se
utiliza la escala Fahrenheit, F, según la cual, el agua congela a 32°F y ebulle
a 212 °F. De este modo, la diferencia entre estos dos puntos de referencia
(esto es, 212 – 32 ), está dividida en 180° F, lo que quiere decir que el
tamaño de un grado Fahrenheit es 1,8 veces menor que el de un grado centígrado o
un kelvin.
La conversión de grados
Fahrenheit a centígrados debe tener en cuenta no sólo esta diferencia de tamaño,
sino también el hecho de que 0°C (punto de congelación del agua) equivalen a
32°F. En la figura 2-12, por ejemplo, el termómetro señala 25°C, lo que corresponde
a 25 divisiones para la longitud AB. Esta misma distancia estará dividida en
1,8 x 25 o 45 divisiones de la escala Fahrenheit. Pero el valor de la
temperatura en °F debe adicionarse además en los 32°F que corresponden a los
0°C. De aquí que 25°C equivale a 45 + 32, o sea 77°F. En general:
°F = (9/5 °C ) + 32
°C = 5/9 ( °F-32)
Se denomina Rankine (símbolo R) a la escala de temperatura que se define midiendo en grados Fahrenheit sobre el cero absoluto, por lo que carece de valores negativos. Esta escala fue propuesta por el físico e ingeniero escocés William Rankine en 1859.
El grado Rankine tiene su punto de cero absoluto a −459,67 °F, y los intervalos de grado son idénticos al intervalo de grado Fahrenheit.
El grado Rankine tiene su punto de cero absoluto a −459,67 °F, y los intervalos de grado son idénticos al intervalo de grado Fahrenheit.
R= F + 459,76
F=R-459,67
F=R-459,67
Cero Rankine (0 R) equivalen a −273,15 °C o 0 K. Para convertir de grados Rankine a Kelvin se multiplica por un factor de 9/5:
R = 9/5 k K=5/9 R
R= 9/5 C + 491,67
C= 5/9 (R-491,67)
R= 9/5 C + 491,67
C= 5/9 (R-491,67)
1. Convierta las siguientes temperaturas a grados
Celsius:
A) 95 °F, en un día caluroso de verano;
B) 12 °F, la temperatura en un día frío de invierno;
C) Una fiebre de 102 °F;
D) Un horno que opera a 1852 °F.
2. Normalmente el cuerpo humano pueda soportar una
temperatura de 105°F por cortos periodos sin sufrir daños permanentes en el cerebro
y otros órganos vitales. ¿Cuál es esta temperatura en grados Celsius?
3. El etilenglicol es un compuesto orgánico liquido que
se utiliza como anticongelante en los radiadores de automóviles. Se congela a—
1 1.5°C. Calcule esta temperatura de congelación en
grados Fahrenheit.
4. La temperatura de la superficie del Sol es de
alrededor de 6300°C, ¿Cuál es la temperatura en grados Fahrenheit?
5. Convierta las siguientes temperaturas a Kelvin:
a) 113°C, el punto de fusión del azufre,
b) 37°C, la temperatura corporal normal,
c) 357°C. el punto
de ebullición del mercurio.
6. Convierta las siguientes temperaturas a grados
Celsius:
d) 77K, el punto de ebullición del nitrógeno líquido.
e) 4.2 K. el punto de ebullición del helio líquido.
f) 601 K, el punto de fusión del plomo
Nota: Dibujar las escalas de temperatura
Nota: Dibujar las escalas de temperatura
4. ACTIVIDAD No. 5
Resume en tu cuaderno el concepto acerca de densidad, realiza dibujos, escribe su formula y realiza los ejercicios propuestos.
Resume en tu cuaderno el concepto acerca de densidad, realiza dibujos, escribe su formula y realiza los ejercicios propuestos.
DENSIDAD
Toda la materia posee masa y
volumen, sin embargo la masa de sustancias diferentes ocupan distintos
volúmenes.
Por ejemplo: notamos que el
hierro o el hormigón son pesados, mientras que la misma cantidad de goma de
borrar o plástico son ligeras.
La propiedad que nos permite
medir la ligereza o pesadez de una sustancia recibe el nombre de densidad.
Cuanto mayor sea la densidad de un cuerpo, más pesado nos parecerá.
La densidad se define como
el cociente entre la masa de un cuerpo y el volumen que ocupa. Así, como en el
Sistema Internacional , la masa se mide en kilogramos (kg) y el volumen en
metros cúbicos (m3) la densidad se medirá en kilogramos por metro cúbico
(kg/m3).
La mayoría de las sustancias
tienen densidades similares a las del agua por lo que, de usar esta unidad, se
estarían usando siempre números muy grandes. Para evitarlo, se suele emplear
otra unidad de medida el gramo por centímetro cúbico (gr/cm3).
La densidad de un cuerpo
está relacionada con su flotabilidad, una sustancia flotará sobre otra si su
densidad es menor.
Por eso la madera flota
sobre el agua y el plomo se hunde en ella, porque el plomo posee mayor densidad
que el agua mientras que la densidad de la madera es menor, pero ambas
sustancias se hundirán en la gasolina, de densidad más baja.
La densidad del agua es 1
gr./cm3, esto quiere decir que 1 litro de agua equivale igualmente a un 1
kilogramo de agua.
DENSIDAD: Es la relación existente entre la masa de un cuerpo y el espacio que éste ocupa. Se expresa mediante la siguiente relación, representando la masa de un cuerpo por unidad de volúmen: en donde D es la densidad del cuerpo, m su masa y V el volúmen que éste ocupa.
ACTIVIDAD No. 6 Ejercicios sobre densidad
ACTIVIDAD No. 6 Ejercicios sobre densidad
1. ¿Cuál es la densidad de un material, si 30 cm cúbicos tiene una masa de 600 gr?
Solución:
Sabemos que
https://blogger.googleusercontent.com/img/b/R29vZ2xl/AVvXsEhwRhxCaMdB18DVPjXtWACJYlXGDz5kLsnhPXH1VTcidK5O6Db6HgGtYt9bpjTnYQmreqj8Y9HdAgxC95xrU89nwM5PQpLMUIu0ZVSQHJPVZxJejBtKq5zP1sdst8g1QkF0XKjLhBCBTIs/?imgmax=800
De los datos del problema sabemos que:
§ m = 600 gr.
§ V = 30 cm3 (cúbicos)
Entonces reemplazando en la formula:
ρ = m / V
ρ = 600 gr / 30 cm3 (cúbicos)
Solución:
Sabemos que
https://blogger.googleusercontent.com/img/b/R29vZ2xl/AVvXsEhwRhxCaMdB18DVPjXtWACJYlXGDz5kLsnhPXH1VTcidK5O6Db6HgGtYt9bpjTnYQmreqj8Y9HdAgxC95xrU89nwM5PQpLMUIu0ZVSQHJPVZxJejBtKq5zP1sdst8g1QkF0XKjLhBCBTIs/?imgmax=800
De los datos del problema sabemos que:
§ m = 600 gr.
§ V = 30 cm3 (cúbicos)
Entonces reemplazando en la formula:
ρ = m / V
ρ = 600 gr / 30 cm3 (cúbicos)
ρ = 20 gr / cm3 (cúbicos)
2. ¿Cuál es la densidad de un material si tiene una masa de 20 kg y un volumen total de 2 metros cúbicos?
Respuesta: 10 Kg / m3 (cúbicos)
Respuesta: 10 Kg / m3 (cúbicos)
3.¿Cuál es la densidad de un material si tiene una masa de 12 libras y un volumen de 6 m3 (cúbicos)?
Solución:
Primero tenemos que pasar la masa de libras a kilogramos
Sabemos que: 1 libra = 0,45 Kilogramos
Entonces: 12 libras = 0,45 x 12 Kg = 5,4 Kg
§ masa (m) = 5,4 Kg
§ V = 6 m3 (cúbicos)
Solución:
Primero tenemos que pasar la masa de libras a kilogramos
Sabemos que: 1 libra = 0,45 Kilogramos
Entonces: 12 libras = 0,45 x 12 Kg = 5,4 Kg
§ masa (m) = 5,4 Kg
§ V = 6 m3 (cúbicos)
Reemplazando en la formula de la densidad:
ρ = m / V
ρ = 5,4 Kg / 6 m3 (cúbicos)
ρ = m / V
ρ = 5,4 Kg / 6 m3 (cúbicos)
ρ = 0,9 Kg / m3 (cúbicos)
4. La densidad del agua es 1.0 g/cm cúbico, ¿Qué volumen ocupara una masa de 3000 gr?
Solución:
Según los datos del problema:
§ ρ = 1 g / cm3 (cúbicos)
Solución:
Según los datos del problema:
§ ρ = 1 g / cm3 (cúbicos)
§ m = 3000 gr
Reemplazando en la formula de la densidad:
ρ = m / V
1 gr / cm3 = 3000 gr / V
V = 3000 / 1 cm3 (cúbicos)
V = 3000 cm3 (cúbicos)
Reemplazando en la formula de la densidad:
ρ = m / V
1 gr / cm3 = 3000 gr / V
V = 3000 / 1 cm3 (cúbicos)
V = 3000 cm3 (cúbicos)
5. La densidad del Cobre es 8.9 g/cm cúbico ¿Qué volumen ocupara una masa de 500 gr?
Respuesta: V = 56,179 cm3 (cúbicos)
Respuesta: V = 56,179 cm3 (cúbicos)
6. La densidad del aire es 0.00129 g/cm cúbico ¿Qué volumen ocupara una masa de 10000 gr?
Respuesta: V = 7751937,98 cm3(cúbicos)
Respuesta: V = 7751937,98 cm3(cúbicos)
7. Un trozo de material tiene un volumen de 2 cm cúbicos si su densidad es igual 2.7 gr / cm cúbico ¿Cuál es su masa?
Solución:
Según los datos del problema:
§ ρ = 2,7 gr / cm
§ V = 2 cm3 (cúbicos)
De la formula de la densidad:
2,7 gr / cm3 = m / 2 cm3 (cúbicos)
m = 2,7 gr / cm3 x 2 cm3 (cúbicos)
m = 5,4 gr
Solución:
Según los datos del problema:
§ ρ = 2,7 gr / cm
§ V = 2 cm3 (cúbicos)
De la formula de la densidad:
2,7 gr / cm3 = m / 2 cm3 (cúbicos)
m = 2,7 gr / cm3 x 2 cm3 (cúbicos)
m = 5,4 gr
8. Un trozo de oro tiene un volumen de 1 cm cúbico, si la densidad del oro es 19.30 gr/cm cúbico. ¿Cuál es su masa?
Respuesta: masa = 19,30 g
Respuesta: masa = 19,30 g
9. Tenemos un cubo de 2 cm de lado y su masa es 24 g. ¿cuál será su densidad?.
ACTIVIDAD No. 7 DE REFLEXIÓN: Realiza una cartelera, pégala en tu salón, donde represente una propiedad de la materia, su definición y su una utilidad en la vida diaria
1. ¿Cuál es la densidad de un material, si 30 cm cúbicos tiene una masa de 600 gr?
Solución:
Sabemos que
https://blogger.googleusercontent.com/img/b/R29vZ2xl/AVvXsEhwRhxCaMdB18DVPjXtWACJYlXGDz5kLsnhPXH1VTcidK5O6Db6HgGtYt9bpjTnYQmreqj8Y9HdAgxC95xrU89nwM5PQpLMUIu0ZVSQHJPVZxJejBtKq5zP1sdst8g1QkF0XKjLhBCBTIs/?imgmax=800
De los datos del problema sabemos que:
§ m = 600 gr.
§ V = 30 cm3 (cúbicos)
Entonces reemplazando en la formula:
ρ = m / V
ρ = 600 gr / 30 cm3 (cúbicos)
ρ = 20 gr / cm3 (cúbicos)
Solución:
Sabemos que
https://blogger.googleusercontent.com/img/b/R29vZ2xl/AVvXsEhwRhxCaMdB18DVPjXtWACJYlXGDz5kLsnhPXH1VTcidK5O6Db6HgGtYt9bpjTnYQmreqj8Y9HdAgxC95xrU89nwM5PQpLMUIu0ZVSQHJPVZxJejBtKq5zP1sdst8g1QkF0XKjLhBCBTIs/?imgmax=800
De los datos del problema sabemos que:
§ m = 600 gr.
§ V = 30 cm3 (cúbicos)
Entonces reemplazando en la formula:
ρ = m / V
ρ = 600 gr / 30 cm3 (cúbicos)
ρ = 20 gr / cm3 (cúbicos)
2. ¿Cuál es la densidad de un material si tiene una masa de 20 kg y un volumen total de 2 metros cúbicos?
Respuesta: 10 Kg / m3 (cúbicos)
Respuesta: 10 Kg / m3 (cúbicos)
3.¿Cuál es la densidad de un material si tiene una masa de 12 libras y un volumen de 6 m3?
Solución:
Primero tenemos que pasar la masa de libras a kilogramos
Sabemos que: 1 libra = 0,45 Kilogramos
Entonces: 12 libras = 0,45 x 12 Kg = 5,4 Kg
§ masa (m) = 5,4 Kg
§ V = 6 m3 (cúbicos)
Reemplazando en la formula de la densidad:
ρ = m / V
ρ = 5,4 Kg / 6 m3 (cúbicos)
ρ = 0,9 Kg / m3 (cúbicos)
Solución:
Primero tenemos que pasar la masa de libras a kilogramos
Sabemos que: 1 libra = 0,45 Kilogramos
Entonces: 12 libras = 0,45 x 12 Kg = 5,4 Kg
§ masa (m) = 5,4 Kg
§ V = 6 m3 (cúbicos)
Reemplazando en la formula de la densidad:
ρ = m / V
ρ = 5,4 Kg / 6 m3 (cúbicos)
ρ = 0,9 Kg / m3 (cúbicos)
4. La densidad del agua es 1.0 g/cm cúbico, ¿Qué volumen ocupara una masa de 3000 gr?
Solución:
Según los datos del problema:
§ ρ = 1 g / cm3 (cúbicos)
§ m = 3000 gr
Reemplazando en la formula de la densidad:
ρ = m / V
1 gr / cm3 = 3000 gr / V
V = 3000 / 1 cm3 (cúbicos)
V = 3000 cm3 (cúbicos)
Solución:
Según los datos del problema:
§ ρ = 1 g / cm3 (cúbicos)
§ m = 3000 gr
Reemplazando en la formula de la densidad:
ρ = m / V
1 gr / cm3 = 3000 gr / V
V = 3000 / 1 cm3 (cúbicos)
V = 3000 cm3 (cúbicos)
5. La densidad del Cobre es 8.9 g/cm cúbico ¿Qué volumen ocupara una masa de 500 gr?
Respuesta: V = 56,179 cm3 (cúbicos)
Respuesta: V = 56,179 cm3 (cúbicos)
6. La densidad del aire es 0.00129 g/cm cúbico ¿Qué volumen ocupara una masa de 10000 gr?
Respuesta: V = 7751937,98 cm3 (cúbicos)
Respuesta: V = 7751937,98 cm3 (cúbicos)
7. Un trozo de material tiene un volumen de 2 cm cúbicos si su densidad es igual 2.7 gr / cm cúbico ¿Cuál es su masa?
Solución:
Según los datos del problema:
§ ρ = 2,7 gr / cm
§ V = 2 cm3 (cúbicos)
De la formula de la densidad:
2,7 gr / cm3(cúbicos) = m / 2 cm3(cúbicos)
m = 2,7 gr / cm3(cúbicos) x 2 cm3(cúbicos)
m = 5,4 gr
Solución:
Según los datos del problema:
§ ρ = 2,7 gr / cm
§ V = 2 cm3 (cúbicos)
De la formula de la densidad:
2,7 gr / cm3(cúbicos) = m / 2 cm3(cúbicos)
m = 2,7 gr / cm3(cúbicos) x 2 cm3(cúbicos)
m = 5,4 gr
8. Un trozo de oro tiene un volumen de 1 cm cúbico, si la densidad del oro es 19.30 gr/cm cúbico. ¿Cuál es su masa?
Respuesta: masa = 19,30 gr
Respuesta: masa = 19,30 gr
9. Tenemos un cubo de 2 cm de lado y su masa es 24 g. ¿cuál será su densidad?.
ESTADOS DE AGREGACIÓN LA MATERIA
ACTIVIDAD No. 8: Definir cada uno de los estados de agregación, con su respectivo dibujo en el cuaderno de química.
https://www.google.com.co/search?q=estado+de+agregación&rlz=1C1GIGM_esCO730CO730&espv=2&biw=1280&bih=645&source=lnms&tbm=isch&sa=X&ved=0ahUKEwjF3cb_j-rRA
ACTIVIDAD No 9
RECONOCIMIENTO DE LOS MATERIALES DE LABORATORIO
(PRACTICA No. 1)
Link de consulta:
http://www.ing.unp.edu.ar/asignaturas/quimica/practicos_de_laboratorio_pdf/lab1.pdf
Teniendo en cuenta el link anterior, realizar lectura general de las practica A y de la practica B.
Copiar en su cuaderno:
PARTE A
1. Objetivos
2. Clasificación de los materiales de laboratorio y dibujarlos
PARTE B
1. Orden y uso de los reactivos
Manejo de los tubos de ensayo
Manejo del mechero de gas
Pasos para encender un mechero
Balanza
Material de vidrio
Manejo de drogas
Lectura de volumenes
Medición de pipeta
medición con probeta
ACTIVIDADES(Programar con el docente y para ese día deberá traer: Bata blanca manga larga, cuaderno con apuntes, 1 hoja examen, gafas de seguridad marcadas, (Señoritas cabello recogido)
QUIZ
Favor ingresar a la plataforma Socrative, no olvidar la sala de llama aula virtual 2015. Alli encontrará el cuestionario habilitado, el día y la hora establecida.
CLASES DE MATERIA
LA
MATERIA SE CLASIFICA EN HOMOGÉNEA Y HETEROGÉNEA.
La materia homogénea es la que
presenta una composición uniforme, en la cual no se pueden distinguir a simple
vista sus componentes; en muchos casos, no se distinguen ni con instrumentos
como el microscopio. Por ejemplo: el agua, la sal, el aire, la leche, el azúcar
y el plástico.
La materia heterogénea es
aquella cuyos componentes se distinguen unos de otros, tal es el caso de la
madera, el mármol, una mezcla de agua con aceite, o bien de frutas, entre otros.
ACTIVIDAD No. 10. Realizar un mapa conceptual sobre el tema de mezclas y tipos de mezclas, dibuja y ejemplo y realiza el mapa conceptual en su cuaderno
MEZCLAS HOMOGÉNEAS Y HETEROGÉNEAS
Sistema Homogéneo: Cuando
todos los elementos que forman una agrupación son iguales (una manada de cebras
serán todas iguales). No se diferencian unos de otros. En química cuando una
sustancia tiene una composición uniforme.
Recuerda, Sustancia = Material constituido por
un solo componente y con las mismas propiedades en todas sus partes,. Por
ejemplo hierro puro, si todo el material son átomos de hierro, será una
sustancia, sustancia pura.
Sistema Heterogéneo:
Agrupación de elementos desiguales, se pueden diferenciar. En química aquel
material en el que se pueden diferenciar las fases o partes que la componen
(varias sustancias o componentes).
¿Qué es una Mezcla?
Una mezcla es una sustancia que está formada
por varios componentes (dos o más), que no pierden sus propiedades y
características por el hecho de mezclarse ya que no se produce una reacción
química entre ellos. Ejemplos de mezclas pueden ser una ensalada, agua salada,
azúcar y sal, etc.
Tipos
de Mezclas
Mezclas homogéneas:
Aquellas mezclas que sus componentes no se pueden diferenciar a simple vista.
Las mezclas homogéneas de líquidos se conocen con el nombre de disoluciones y
están constituidas por un soluto y un disolvente, siendo el primero el que se
encuentra en menor proporción y además suele ser el líquido. Por ejemplo, el
agua mezclada con sales minerales o con azúcar, el agua es el disolvente y el
azúcar el soluto.
Mezclas
Heterogéneas: Aquellas mezclas en las que sus componentes
se pueden diferenciar a simple vista.
EJEMPLO
Por ejemplo el chocolate es una mezcla homogénea por que aunque parezca un solo producto por la parte de atrás del envoltorio te habrás fijado que vienen los componentes (leche, cacao, grasa, etc.), por lo tanto son varios componentes y no se diferencian unos de otros en la mezcla. ¿Qué tipo de mezcla es....? Pues sí, es una mezcla homogénea.
EJEMPLO
Por ejemplo el chocolate es una mezcla homogénea por que aunque parezca un solo producto por la parte de atrás del envoltorio te habrás fijado que vienen los componentes (leche, cacao, grasa, etc.), por lo tanto son varios componentes y no se diferencian unos de otros en la mezcla. ¿Qué tipo de mezcla es....? Pues sí, es una mezcla homogénea.
Una roca que tenga varios componentes, como
por ejemplo el gneis y además se distingan a simple vista, será heterogénea.
Roca gneis
Hay un tipo de mezclas que en química se
suelen llamar disoluciones. Cuando en una mezcla homogénea uno de los dos
componentes es líquido, normalmente agua, ha esta mezcla homogénea es a lo que
se le suele llamar disolución. Las disoluciones químicas suelen estar en estado
líquido. Se le suele llamar soluto a la parte sólida y disolvente a la parte
líquida de la mezcla.
ACTIVIDAD No. 11 Define y dibuja cada método de separación de mezclas
MÉTODOS DE SEPARACIÓN DE MEZCLAS
Las mezclas vienen en muchas formas y fases.
La mayoría de ellas se pueden separar de nuevo en sus componentes originales.
El tipo de método de separación depende del tipo de mezcla que sea. A
continuación presentamos algunos métodos de separación de mezclas más comunes.
Al final tienes una imagen resumen de los métodos que explicamos. Mira la
imagen cada vez que leas un método para entenderlo mejor.
Las técnicas que se utilizan para la
separación de mezclas son:
Tamización: esta
puede ser utilizada para la separación de mezclas sólidas, compuestas con
granos de diversos tamaños. Lo que se hace es hacer pasar a la mezcla por
varios tamices (tabla con agujeros de pequeño tamaño).
Filtración:
esta técnica permite la separación de aquellas mezclas que están compuestas por
líquidos y sólidos no solubles, es decir que los sólidos no se disuelven en el
líquido. Por ejemplo el azúcar se disuelve con el agua, pero si echamos arena
esta no se disuelve, es decir no es soluble. Para separar estas mezclas, se
utiliza un embudo con un papel de filtro en su interior. Lo que se hace pasar a
la mezcla por ellos.
Separación
magnética: esta técnica sólo es útil a la hora de separar sustancias con
propiedades magnéticas de aquellas que no las poseen. Para esto, se utilizan
imanes que atraen a las sustancias magnéticas y así se logra separarlas de las
que no lo son.
Decantación: Decantar es dejar
reposar la mezcla. Esta técnica sirve para la separación de líquidos que tienen
diferentes densidades y no son solubles entre sí. En esta técnica se requiere
un embudo de decantación que contiene una llave para la regulación del líquido.
Una vez decantada la mezcla (dejar en reposo) el elemento más denso irá al
fondo y por medio del embudo de decantación, cuando se abre la llave se permite
el paso del líquido más denso hacia un recipiente ubicado en la base, quedando
el líquido con menor densidad en la parte de arriba del embudo.
Cristalización
y precipitación: esta permite la separación de un soluto sólido de que se
encuentra disuelto en un disolvente. Se calienta la disolución para
concentrarla, luego se la filtra y se la coloca en un cristalizador hasta que
se evapore el líquido, quedando el sólido en forma de cristal.
Destilación: es útil para la
separación de líquidos que son solubles entre sí. Lo que se hace es hervirlos
y, como esto lo hacen a distintas temperaturas de ebullición, se toman sus
vapores por un tubo para luego pasarlo al estado líquido nuevamente. Esto es
posible gracias a que hierven en distintos tiempos. Por ejemplo imaginemos agua
y sal. El agua hierve a 100ºC, si calentamos la mezcla a esa temperatura lo que
se evapora será el agua, la sal no se evaporará (tiene temperatura de
ebullición más alta). Si recogemos el vapor tenemos el agua separada de la sal.
Cromatografía:
Cromatografía en capa fina (CCF)
En la cromatografía en capa fina (CCF) la fase estacionaria consiste en una capa delgada de un adsorbente (como por ejemplo gel de sílice, alúmina o celulosa) depositada sobre un soporte plano como una placa de vidrio, o una lámina de aluminio o de plástico.
La CCF es una técnica analítica y tiene como objetivo el análisis de una mezcla de componentes.
El proceso es similar a la cromatografía de papel con la ventaja de que se desarrolla más rápidamente, proporciona mejores separaciones y se puede elegir entre diferentes adsorbentes. La CCF es una técnica estándar en el laboratorio de química orgánica. Debido a su simplicidad y velocidad, la CCF se utiliza a menudo para monitorizar las reacciones químicas y también para el análisis cualitativo de los productos de una reacción, puesto que permite conocer de manera rápida y sencilla cuántos componentes hay en una mezcla.
Cromatografía en capa fina (CCF)
En la cromatografía en capa fina (CCF) la fase estacionaria consiste en una capa delgada de un adsorbente (como por ejemplo gel de sílice, alúmina o celulosa) depositada sobre un soporte plano como una placa de vidrio, o una lámina de aluminio o de plástico.
La CCF es una técnica analítica y tiene como objetivo el análisis de una mezcla de componentes.
El proceso es similar a la cromatografía de papel con la ventaja de que se desarrolla más rápidamente, proporciona mejores separaciones y se puede elegir entre diferentes adsorbentes. La CCF es una técnica estándar en el laboratorio de química orgánica. Debido a su simplicidad y velocidad, la CCF se utiliza a menudo para monitorizar las reacciones químicas y también para el análisis cualitativo de los productos de una reacción, puesto que permite conocer de manera rápida y sencilla cuántos componentes hay en una mezcla.
CONSUTAR EL SIGUIENTE LINK
http://tiempodeexito.com/quimicain/05.html
ACTIVIDAD No. 13
PRÁCTICA DE LABORATORIO No. 2
MÉTODOS DE SEPARACIÓN DE MEZCLAS
Preparar y separar mezclas según la naturaleza de sus componentes
Identificar los procesos de separación de mezclas
Materiales y Reactivos:
Vaso de precipitado de 100, 250, 400 mL
Embudo tallo largo
Papel de filtro
Vidrio reloj
Cápsula de evaporación
Embudo de separación
Balanza de un plato
Cilindro graduado de 10 y 50 mL
Balones aforados de 100 y 250 mL
Pipeta volumétrica de 5 mL
Pipeta graduada de 5, 10 mL
Agitadores
Colador
Arena
Sal
Aceite vegetal
Agua
NaCl.
Limaduras de hierro
Harina
Lentejas
Introducción
En la fabricación de medicinas, alimentos y otros productos químicos la pureza de las sustancias es esencial. La pureza es una de las ideas mas antiguas y recurrentes; pues el grado de pureza de una sustancia y su determinación es fundamental. En el laboratorio es necesario - la mayoría de las veces- trabajar con sustancias puras, para que alguna impureza no interfiera en el experimento planeado. Obtener sustancias puras significa haber eliminado otras sustancias, al separarlas de la primera.
Para lograr una separación se aprovecha el hecho de que los diversos componentes de una mezcla tiene diferentes propiedades físicas y químicas. En general, una separación es la operación por la cual una mezcla se divide en al menos dos fracciones de diferente composición.
Las principales técnicas de separación basadas en las diferencias de las propiedades de los componentes de las mezclas se muestran en la siguiente tabla:
TÉCNICAS DE SEPARACIÓN
1. Fltración
2. Destilación
3. Sublimación
4. Extracción
5. Cristalización
6. Cromatografía
PRINCIPIO
1. Baja solubilidad
2. Diferencia Punto de ebullición
3. Diferencia Punto de sublimación
4. Diferencia. de solubilidad en dos disolventes inmiscibles
5. Diferencia de solubilidad en dos disolventes fríos y calientes
6. Diferencia Movilidad de una sustancia que migra a través de un soporte.
ACTIVIDAD
Organizar el grupo de clase en 6 grupos y el profesor asignará a cada grupo de estudiantes un experimento que deberá realizar y explicar a los demas compañeros con la ayuda del docente.
PROCEDIMIENTO
Grupo No. 1
Preparación de una mezcla de arena y sal
1. En un vaso de precipitado pese 5 gr. de NaCl y 5 gr. de arena.
2. Añada 20 mL de agua de chorro y mezcle con el agitador. Observe como cambia la apariencia de la arena y el cloruro de sodio al combinarlos con agua.
3. Doble el papel de filtro previamente pesado en cuartos, ábralo formando un cono y colóquelo en el embudo humedeciendo con agua del grifo para fijarlo.
Evaporación
4. Coloque el embudo en un porta embudos e introduzca el tallo del embudo en un vaso de precipitados (beaker). Vierta la mezcla preparada sobre el papel cuidadosamente, transfiera todos los residuos de arena arrastrando con agua del grifo.
5. Al final vierta agua sobre el papel de filtro para que baje hasta el beaker.
6. Vierta el líquido filtrado en una cápsula de porcelana (debe pesarla previamente) colóquela sobre mechero de alcohol hasta alcanzar la sequedad. Deje enfriar la cápsula y péselo. Anote sus observaciones.
Informe:
a. Complete el siguiente cuadro:
GRUPO No.2
Preparación de una mezcla de aceite y agua.
1. En un beaker coloque 10 mL de aceite vegetal y 20 mL de agua. Agite cuidadosamente con el agitador y anote sus observaciones.
2. Transfiera la mezcla a un embudo de separación. Intente transferir todo el aceite arrastrándolo con más agua.
Grupo No. 1
Preparación de una mezcla de arena y sal
1. En un vaso de precipitado pese 5 gr. de NaCl y 5 gr. de arena.
2. Añada 20 mL de agua de chorro y mezcle con el agitador. Observe como cambia la apariencia de la arena y el cloruro de sodio al combinarlos con agua.
3. Doble el papel de filtro previamente pesado en cuartos, ábralo formando un cono y colóquelo en el embudo humedeciendo con agua del grifo para fijarlo.
4. Coloque el embudo en un porta embudos e introduzca el tallo del embudo en un vaso de precipitados (beaker). Vierta la mezcla preparada sobre el papel cuidadosamente, transfiera todos los residuos de arena arrastrando con agua del grifo.
5. Al final vierta agua sobre el papel de filtro para que baje hasta el beaker.
6. Vierta el líquido filtrado en una cápsula de porcelana (debe pesarla previamente) colóquela sobre mechero de alcohol hasta alcanzar la sequedad. Deje enfriar la cápsula y péselo. Anote sus observaciones.
7. Coloque
el papel de filtro con la arena en una cápsula de porcelana (debe
pesarla previamente) con un vidrio de reloj, colóquela sobre mechero de
alcohol hasta alcanzar la sequedad. Deje enfriar y péselo. Anote sus
observaciones.
Informe:
a. Complete el siguiente cuadro:
Técnica de separación utilizado
|
Principio
|
b. Sustancias recuperadas:
Peso del vidrio de reloj_______________
Peso de la capsula de porcelana ___________
Peso de papel de filtro__________
Peso de sal recuperada ____________
Peso de arena recuperada __________
Peso de la capsula de porcelana ___________
Peso de papel de filtro__________
Peso de sal recuperada ____________
Peso de arena recuperada __________
GRUPO No.2
Preparación de una mezcla de aceite y agua.
1. En un beaker coloque 10 mL de aceite vegetal y 20 mL de agua. Agite cuidadosamente con el agitador y anote sus observaciones.
2. Transfiera la mezcla a un embudo de separación. Intente transferir todo el aceite arrastrándolo con más agua.
4.Cuando sólo quede aceite en el embudo transfiéralo a un cilindro graduado, anote el volumen obtenido.
Informe:
Técnica de separación utilizado
|
Principio
|
Volumen de agua recuperado________ Volumen de aceite recuperado_______
Masa de agua recuperada________ Masa de aceite recuperada________
Densidad del agua_________ Densidad del aceite________
GRUPO No.3
Preparación De Una Mezcla De harina de maíz y granos.
1. Observe características iniciales de los componentes de la mezcla. (Arena, Arroz, Harina)
2. Utilice un tamiz suministrado por el profesor. Observe y anote sus resultados:
Destilación
La destilación es la operación de separar, mediante vaporización y condensación en los diferentes componentes líquidos, sólidos disueltos en líquidos o gases licuados de una mezcla, aprovechando los diferentes puntos de ebullición de cada una de las sustancias ya que el punto de ebullición es una propiedad intensiva de cada sustancia, es decir, no varía en función de la masa o el volumen, aunque sí en función de la presión
La destilación fraccionada es una variante de la destilación simple que se emplea principalmente cuando es necesario separar líquidos con punto de ebullición cercanos.
En química, se llama destilación simple o destilación sencilla a un tipo de destilación donde los vapores producidos son inmediatamente canalizados hacia un condensador, el cual lo refresca y condensa de modo que el destilado no resulta puro. Su composición será idéntica a la composición de los vapores a la presión y temperatura dados.
La destilación sencilla, se usa para separar aquellos líquidos cuyos puntos de ebullición difieren extraordinariamente (en más de 80°C aproximadamente) o para separar líquidos de sólidos no volátiles.
El aparato utilizado para la destilación en el laboratorio es el alambique. Consta de un recipiente donde se almacena la mezcla a la que se le aplica calor, un condensador donde se enfrían los vapores generados, llevándolos de nuevo al estado líquido y un recipiente donde se almacena el líquido concentrado.
En la industria química se utiliza la destilación para la separación de mezclas simples o complejas. Una forma de clasificar la destilación puede ser la de que ésta sea discontinua o continua.
GRUPO No. 5
Lixiviación
La palabra lixiviación viene del latín: “Lixivia, -ae” sustantivo femenino que significa lejía. Los romanos usaban este término para referirse a los jugos que destilan las uvas antes de pisarlas, o las aceitunas antes de molerlas.
En la actualidad, se denomina lixiviación, al lavado de una sustancia pulverizada para extraer las partes solubles.
GRUPO No. 6
Cromatografía
Para realizar el experimento, utilizar papel klinex, alcohol y plumones de diferentes colores, cinta pegante y un palo de pincho.
https://www.youtube.com/watch?v=_Zr5fOTmbBE
Las técnicas cromatografías son muy variadas, pero en todas ellas hay una fase móvil que consiste en un fluido (gas, líquido o fluido supercrítico) que arrastra a la muestra a través de una fase estacionaria que se trata de un sólido o un líquido fijado en un sólido.
Los componentes de la mezcla interaccionan en distinta forma con la fase estacionaria y con la fase móvil. De este modo, los componentes atraviesan la fase estacionaria a distintas velocidades y se van separando. Después de haber pasado los componentes por la fase estacionaria y haberse separado pasan por un detector que genera una señal que puede depender de la concentración y del tipo de compuesto.
Actividad: Presentar el informe de laboratorio, según las normas estableciadas, en la siguiente clase.
TALLER
TEMA: CLASES DE SUSTANCIAS Y MÉTODOS DE SEPARACIÓN
TEMA: CLASES DE SUSTANCIAS Y MÉTODOS DE SEPARACIÓN
A continuación, observas un mapa conceptual acerca de las clases de materia que existen. Con base en el completa y responde las preguntas o actividades que allí se presentan.
5. En su orden, los cambios de estado que tienen lugar durante el ciclo del agua, desde la lluvia, son:
A. Condensación, solidificación, evaporación
B. Solidificación, evaporación, sublimación
C. Fusión, evaporación, Condensación
D. Vaporización, Sublimación, condensación
6· Para que una mezcla de huevos, harina, azúcar y mantequilla logre ser homogénea y obtener una consistencia suave en la fabricación de tortas y ponqués, debemos:
A. Agregar muchos huevos para no batir tanto
B. Batir enérgicamente antes de hornear
C. Hornear por 2 horas
D. No agregar la harina.
ACTIVIDAD No. 13 Copia el siguiente esquema en tu cuaderno y da 5 ejemplos de cada uno.
ESTADOS DE LA MATERIA
ESTADOS DE LA MATERIA
ACTIVIDAD No. 14
LA MATERIA Y SUS ESTADOS
LA MATERIA Y SUS ESTADOS
(Realice lectura inferencial del siguiente texto y construya un mapa conceptual)
La materia puede encontrarse en varios estados, pero también
puede cambiar de estado cuando se aumenta o disminuye la temperatura o la presión
en el caso de los gases.
Los cambios de estado de la materia reciben su nombre
dependiendo del fenómeno que ocurre. Cuando la materia cambia de estado
generalmente las moléculas se unen o separan según el caso.
CAMBIOS DE ESTADO DE LA MATERIA
La materia cambia de un estado a otro por efecto de la
temperatura y presión, ya sea aumentando o disminuyendo la energía calórica. En
la naturaleza es frecuente observar que la materia cambia de un estado a otro.
Tal vez el ejemplo más conocido sea el caso del agua, que se puede encontrar en
forma sólida, líquida y gaseosa.
Se reconocen 2 tipos de cambios de estado: Progresivos y
regresivos.
Cambios de estado progresivos:
Los cambios de estado progresivos se producen cuando se
aplica calor a los cuerpos y son: sublimación progresiva, fusión y evaporación.
Sublimación progresiva:
Este cambio se produce cuando un cuerpo pasa del estado
sólido al gaseoso directamente. Ejemplo: sublimación del yodo, sublimación de
la naftalina.
Fusión
Es el paso de una sustancia, del estado sólido al líquido
por la acción del calor. La temperatura a la que se produce la fusión es
característica de cada sustancia. Por ejemplo, la temperatura a la que ocurre
la fusión del hielo es 0º C. La temperatura constante a la que ocurre la fusión
se denomina Punto de Fusión. A esta temperatura existe un equilibrio entre el
estado cristalino de alta ordenación y el estado líquido más desordenado.
Evaporación
Es el paso de una sustancia desde el estado líquido al
gaseoso. Este cambio de estado ocurre normalmente a la temperatura ambiente, y
sin necesidad de aplicar calor. Bajo esas condiciones, sólo las partículas de
la superficie del líquido pasarán al estado gaseoso, mientras que aquellas que
están más abajo seguirán en el estado inicial.
Sin embargo, si se aplica mayor calor, tanto las partículas
de la superficie como las del interior del líquido podrán pasar al estado
gaseoso. El cambio de estado así producido se llama Ebullición. La temperatura
que cada sustancia necesita para alcanzar la ebullición es característica de
cada sustancia y se denomina Punto de Ebullición. Por ejemplo, el punto de
ebullición del H2O a nivel del mar es 100º C.
Cambios de estado regresivos:
Los cambios de estado regresivos son aquellos que se
producen cuando los cuerpos se enfrían. Se reconocen 3 tipos: Sublimación
regresiva, solidificación y condensación.
Sublimación regresiva:
Es el cambio de estado que ocurre cuando una sustancia
gaseosa se vuelve sólida, sin pasar por el estado líquido.
Solidificación:
Es el paso de una sustancia desde el estado líquido al
sólido. Este proceso ocurre a una temperatura característica para cada
sustancia denominada punto de solidificación y que coincide con su punto de
fusión.
Condensación:
Es el cambio de estado que se produce en una sustancia al
pasar del estado gaseoso al estado líquido. La temperatura a la que ocurre esta
transformación se llama punto de condensación y corresponde al punto de
ebullición.
OTROS ESTADOS DE LA MATERIA
El plasma es un estado que
adoptan los gases cuando se calientan a elevadas temperaturas del orden de
10.000°C: las moléculas adquieren tanta energía cinética, que los frecuentes
choques provocan la ruptura de las moléculas e incluso de los átomos, lo que
origina una mezcla de iones positivos y electrones deslocalizados, donde el
número de cargas, además de los átomos y las moléculas, es prácticamente el
mismo.
El superfuido es un estado
que se consigue cuando un gas, como el helio, se licua a altas presiones y
temperaturas cercanas al cero absoluto. La sustancia se comporta como un
líquido que trepa por las paredes y escapa. Presenta muy poca fricción y
viscosidad.
CAMBIOS
ACTIVIDAD No. 15 (Realiza resumen del siguiente texto)
Todos los
materiales que vemos y tenemos a nuestro alrededor constantemente sufren
cambios. Por ejemplo: la fruta se madura, los charcos se evaporan, las hojas de
los árboles se amarillean, podemos moldear el barro, patear un balón, etc.
Algunos de
estos cambios son producidos por el hombre, por ejemplo cortar papel, disolver
azúcar en el café, cocinar los alimentos, elaborar quesos, otros cambios son
producto de la naturaleza por ejemplo, cuando cae un rayo, la formación de la
lluvia, la realización de la fotosíntesis, etc. Los cambios de la materia se
clasifican en cambios físicos, cambios químicos y nucleares.
CAMBIOS FÍSICOS
¿Qué le pasa
al cubo de hielo cuando se deja fuera del congelador por un tiempo? , si cambia
de estado, ¿hay alguna forma de que vuelva a ser un cubo de hielo?
Son aquellos
cuando la materia NO cambia en su estructura, ni su composición; es decir solo
cambia su tamaño, su forma, su posición o su estado de agregación, ocurre un
cambio físico. Por ejemplo la solidificación del agua: al bajar su temperatura
a cero grados centígrados, ésta se congela y forma hielo, pasa del estado
líquido al estado sólido, pero sigue siendo agua.
Son ejemplos
de cambios físicos de la materia: la evaporación del agua:
Hacer leña de
un árbol
Cortar un
papel
Hacer una
vasija de barro
Rodar un balón
La sublimación del iodo
La fusión del cobre
CAMBIOS QUÍMICOS
Si quemamos un papel, ¿éste podrá
regresar a su estado original? ¿por qué?
Son aquellos cuando la materia
cambia en su composición y propiedades es un cambio químico; es decir las
sustancias iniciales se transforman y no se parecen a las sustancias obtenidas
después del cambio ocurre un cambio químico, por ejemplo la fermentación del
jugo de la uva produce el vino: el jugo de uva es muy dulce y rico en glucosa,
una vez fermentado se obtiene alcohol etílico, que es una sustancias con
diferentes propiedades a la glucosa que es un azúcar.
Son ejemplos de cambios químicos:
Las combustiones
Las oxidaciones de los metales
La fotosíntesis
La putrefacción
La respiración
El crecimiento de una planta
CAMBIOS NUCLEARES
Son aquellos que implican la transformación de los átomos,
implican una gran cantidad de energía y pueden ser de dos tipos: fisión nuclear
y fusión nuclear.
La fusión nuclear es el proceso mediante el cual dos núcleos
atómicos se unen para formar uno de mayor peso atómico, por ejemplo en el Sol
se unen los núcleos de hidrógeno para formar átomos de helio, por medio de le
fusión nuclear.
La fisión es un proceso nuclear, lo que significa que tiene
lugar en el núcleo del átomo. La fisión ocurre cuando un núcleo se divide en
dos o más núcleos pequeños, más algunos subproductos, por ejemplo en la bomba
atómica los átomos de uranio se fraccionan en átomos más pequeños.
ACTIVIDAD No. 17
CUESTIONARIO
CUESTIONARIO
CONTESTA LAS SIGUIENTES PREGUNTAS EN TU CUADERNO
1.- ¿Cuál es la diferencia entre un cambio químico y un
cambio físico?
2.- ¿Explica por qué la maduración de la fruta es un cambio
químico?
3.- ¿Cuál es la principal característica del cambio físico?
4.- Si dentro de un cambio de la materia se presenta un
cambio de olor y la formación
de una nueva sustancia se trata de un cambio...........
5.- Clasifica los siguientes cambios de la materia y dibuja
y anota delante de cada uno a que tipo
Pertenece:
a) Disolver azúcar en agua
b) Freír una chuleta
c) Arrugar un papel
d) El proceso de la digestión
e) Secar la ropa al sol
f) Congelar una paleta de agua
g) Hacer un avión de papel
h) Oxidación del cobre
i) Combustión de la gasolina.
ACTIVIDAD No. 18
Presentar una guía de laboratorio, diseñada para estudiantes de pre-escolar y primaria, con el fin de realizar servicio social con ellos, monitoreando en grupos de 4 estudiantes una practica de laboratorio
MODELOS ATÓMICOS
Actividad No. 19
Realizar la marcación en tu cuaderno con "Segundo trimestre" y copia los EBD-DBA, LOGROS Y CONTENIDOS.
4B. Utilizando los pesos moleculares del ejercicio anterior calcule el peso en gramos de:
5. B. Observa con atención los esquemas que representan modelos de sólidos, líquidos y gases. Luego, compara las propiedades de cada estado de acuerdo con los siguientes criterios:
Compara los modelos atómicos de Dalton, Thomson y Rutherford, y escribe cinco deiferencias.
RESUMEN DE LOS APORTES DE LOS
CIENTÍFICOS AL MODELO ACTUAL
PROFESORA: MAYELA DABDUB MOREIRA
Demócrito: El átomo es
indivisible
DALTON Para Dalton los átomos
eran esferas macizas. Estableció la teoría atómica: teoría se puede resumir en:
1.- Los elementos químicos están formados por
partículas muy pequeñas e indivisibles llamadas átomos.
2.- Todos los átomos de un
elemento químico dado son idénticos en su masa y demás propiedades. 3.- Los
átomos de diferentes elementos químicos son distintos, en particular sus masas
son diferentes.
4.- Los átomos son indestructibles y retienen
su identidad en los cambios químicos.
5.- Los compuestos se forman
cuando átomos de diferentes elementos se combinan entre sí, en una relación de
números enteros sencilla, formando entidades definidas (hoy llamadas moléculas)
THOMSON Según el modelo de
Thomson el átomo consistía en una esfera uniforme de materia cargada
positivamente en la que se hallaban incrustados los electrones de un modo
parecido a como lo están las semillas en una sandía. El modelo del pudín.
Usando un tubo de rayos catódicos, logró determinar la existencia de partículas
negativas en el átomo. Además logró determinar la relación entre la carga y la
masa, obteniendo un valor de 1,76 x 108C/g
MODELO DEL PUDÍN
Milikan: determinó la carga del
electrón: 1,6 x10-19C.
ERNEST RUTHERFORD Bombardea una
lámina de oro con partículas alfa concluyó de su experimento que en el átomo
existe un núcleo positivo donde se concentra la masa. y un espacio prácticamente
vacío donde pueden estar los electrones.
3 Rutherford poseía información
sobre el tamaño, masa y carga del núcleo, pero no tenía información alguna
acerca de la distribución o posición de los electrones. En el modelo de
Rutherford, los electrones se movían alrededor del núcleo como los planetas
alrededor del sol. Los electrones no caían en el núcleo, ya que la fuerza de
atracción electrostática era contrarrestada por la tendencia del electrón a
continuar moviéndose en línea recta. Este modelo fue satisfactorio hasta que se
observó que estaba en contradicción con una información ya conocida en aquel
momento: de acuerdo con las leyes del electromagnetismo, un electrón o todo
objeto eléctricamente cargado que es acelerado o cuya dirección lineal es
modificada, emite o absorbe radiación electromagnética
1. El átomo está constituido por
una zona central, a la que se le llama núcleo, en la que se encuentra concentrada
toda la carga positiva y casi toda la masa del núcleo.
2. Hay otra zona exterior del
átomo, la corteza, en la que se encuentra toda la carga negativa y cuya masa es
muy pequeña en comparación con la del átomo. La corteza está formada por los
electrones que tenga el átomo.
3. Los electrones se están
moviendo a gran velocidad en torno al núcleo.
4. El tamaño del núcleo es muy
pequeño en comparación con el del átomo (unas 100.000 veces menor
MODELO PLANETARIO
A pesar de constituir un gran avance y de predecir hechos reales, el modelo nuclear de Rutherford presentaba dos graves inconvenientes:
1. Contradecía las leyes electromagnéticas de Maxwell, según las cuales, una partícula cargada, cuando posee aceleración, emite energía electromagnética.
2. Según el enunciado anterior los espectros atómicos debería ser continuos, ocurriendo que éstos son discontinuos, formados por líneas de una frecuencia determinada.
NIELS BOHR
La teoría de los cuantos de Planck aportó a Bohr dos ideas:
1. Las oscilaciones eléctricas del átomo solo pueden poseer cantidades discretas de energía (están cuantizados)
2. Sólo se emite radiación cuando el oscilador pasa de un estado cuantizado a otro de mayor energía.
El modelo de Bohr se puede resumir en tres postulados:
1- Los electrones se mueven alrededor del núcleo en trayectorias definidas llamadas órbitas.
2- Los electrones están ubicados en niveles definidos de energía; los niveles más internos son los menos energéticos.
3- Cuando los electrones ganan o pierden cuantos de energía es porque se han movido de un nivel a otro.
1. Contradecía las leyes electromagnéticas de Maxwell, según las cuales, una partícula cargada, cuando posee aceleración, emite energía electromagnética.
2. Según el enunciado anterior los espectros atómicos debería ser continuos, ocurriendo que éstos son discontinuos, formados por líneas de una frecuencia determinada.
NIELS BOHR
La teoría de los cuantos de Planck aportó a Bohr dos ideas:
1. Las oscilaciones eléctricas del átomo solo pueden poseer cantidades discretas de energía (están cuantizados)
2. Sólo se emite radiación cuando el oscilador pasa de un estado cuantizado a otro de mayor energía.
El modelo de Bohr se puede resumir en tres postulados:
1- Los electrones se mueven alrededor del núcleo en trayectorias definidas llamadas órbitas.
2- Los electrones están ubicados en niveles definidos de energía; los niveles más internos son los menos energéticos.
3- Cuando los electrones ganan o pierden cuantos de energía es porque se han movido de un nivel a otro.
SCHRÖDINGER Con
estas dos partículas, se intentó construir todos los átomos conocidos, pero no
pudo ser así porque faltaban unas de las partículas elementales del núcleo que
fue descubierto por J. Chadwick en 1932 y que se llamó neutrón.
Esta partícula
era de carga nula y su masa es ligerísimamente superior a la del protón
(1,6748210-27kg.). Sin negar el considerable avance que supuso la teoría
atómica de Bohr, ésta solo podía aplicarse a átomos muy sencillos, y aunque
dedujo el valor de algunas constantes, que prácticamente coincidían con los
valores experimentales sencillos, el modelo no fue capaz de explicar los
numerosos saltos electrónicos, responsables de las líneas que aparecen en los
espectros de los átomos que poseen más de un electrón. Al modelo de Bohr se le
fueron introduciendo mejoras, pero la idea de un átomo compuesto por orbitas
alrededor de un núcleo central puede considerarse demasiado sencilla, no fue
posible interpretar satisfactoriamente el espectro de otros átomos con más de
un electrón (átomos polielectrónicos) ni mucho menos la capacidad de los átomos
para formar enlaces químicos.
Basándose en la
hipótesis de L. De Broglie y considerando que el movimiento del electrón es
análogo a un sistema de ondas estacionarias, el físico austriaco Erwin
Schrödinger propuso una ecuación de onda aplicable al átomo de hidrógeno, sus
resultados se dan en términos de la probabilidad de encontrar un electrón en
vez de localizarlo fijamente en una órbita como hizo Bohr. Este predijo órbitas
planetarias, pero Schrödinger predice regiones en las cuales la probabilidad de
encontrar un electrón es mayor.
Planck establece que la energía que emite o absorbe un átomo está formada por pequeños paquetes o cuantos de energía. La energía de cada uno de los cuantos que emite o absorbe el átomo viene dada por la expresión E = h . f La mecánica cuántica se basa en la teoría de Planck, y tomó como punto de partida la dualidad onda-corpúsculo de Louis De Broglie y el principio de incertidumbre de Heisenberg.
En 1924 Louis De Broglie extendió el carácter dual de la luz a los electrones, protones, neutrones, átomos y moléculas, y en general a todas las partículas materiales. Basándose en consideraciones relativistas y en la teoría cuántica pensó que si la luz se comportaba como onda y como partícula la materia debería poseer este carácter dual. Principio de incertidumbre de Heisenberg Publicada en el 1927. Uno de los aspectos más importantes de la mecánica cuántica es que no es posible determinar simultáneamente, de un modo preciso, la posición y la cantidad de movimiento de una partícula. Esta limitación se conoce con el nombre de principio de incertidumbre o de indeterminación de Heisenberg. El principio de incertidumbre es una consecuencia de la dualidad ondapartícula de la radiación y de la materia. Todos los objetos, independientemente de su tamaño, están regidos por el principio de incertidumbre, lo que significa que su posición y movimiento se pueden expresar solamente como probabilidades.
Principio de exclusión de Pauli: no es posible encontrar dos electrones de un mismo átomo que tengan los cuatro números cuánticos iguales.
El principio de Aufbau: en el proceso de construir la estructura electrónica de cualquier átomo supone que los electrones llenan primero los subniveles de menor energía.
La regla de Hund establece que los electrones ocuparán el mayor número de orbitales disponibles en un subnivel.
En 1924 Louis De Broglie extendió el carácter dual de la luz a los electrones, protones, neutrones, átomos y moléculas, y en general a todas las partículas materiales. Basándose en consideraciones relativistas y en la teoría cuántica pensó que si la luz se comportaba como onda y como partícula la materia debería poseer este carácter dual. Principio de incertidumbre de Heisenberg Publicada en el 1927. Uno de los aspectos más importantes de la mecánica cuántica es que no es posible determinar simultáneamente, de un modo preciso, la posición y la cantidad de movimiento de una partícula. Esta limitación se conoce con el nombre de principio de incertidumbre o de indeterminación de Heisenberg. El principio de incertidumbre es una consecuencia de la dualidad ondapartícula de la radiación y de la materia. Todos los objetos, independientemente de su tamaño, están regidos por el principio de incertidumbre, lo que significa que su posición y movimiento se pueden expresar solamente como probabilidades.
Principio de exclusión de Pauli: no es posible encontrar dos electrones de un mismo átomo que tengan los cuatro números cuánticos iguales.
El principio de Aufbau: en el proceso de construir la estructura electrónica de cualquier átomo supone que los electrones llenan primero los subniveles de menor energía.
La regla de Hund establece que los electrones ocuparán el mayor número de orbitales disponibles en un subnivel.
CARACTERÍSTICAS DEL ÁTOMO
1-Raramente se presentan en forma aislada en la naturaleza.
2-Tiene un diámetro de 1x10-10 m
3-Es la partícula más pequeña de un elemento que interviene en una reacción química para formar compuestos.
4-Es eléctricamente neutro en su estado natural, porque tiene igual número de cargas positivas en su núcleo que de negativas en la periferia. Al igualar las cargas eléctricas se neutraliza.
5-Puede perder su estado natural y transformarse en un ión positivo o negativo.
REPRESENTACIÓN SIMBÓLICA DE LAS PARTÍCULAS SUBATÓMICAS X= símbolo del elemento A= Número másico Z= número atómico N= número de electrones.
1-Raramente se presentan en forma aislada en la naturaleza.
2-Tiene un diámetro de 1x10-10 m
3-Es la partícula más pequeña de un elemento que interviene en una reacción química para formar compuestos.
4-Es eléctricamente neutro en su estado natural, porque tiene igual número de cargas positivas en su núcleo que de negativas en la periferia. Al igualar las cargas eléctricas se neutraliza.
5-Puede perder su estado natural y transformarse en un ión positivo o negativo.
REPRESENTACIÓN SIMBÓLICA DE LAS PARTÍCULAS SUBATÓMICAS X= símbolo del elemento A= Número másico Z= número atómico N= número de electrones.
ACTIVIDAD No. 19 Realiza en tu cuaderno resumen de las reglas presentadas: regla de Hund y principio de exclusión de Pauli, dibuja los esquemas.
La regla de Hund es un método empírico utilizado para el llenado de orbitales que posea igual energía. Dicha regla fue acuñada por el físico alemán Friedrich Hund, y es conocida también bajo el nombre de regla de máxima multiplicidad de Hund.
La regla se basa en el llenado de orbitales atómicos que tengan igual energía, así podemos decir que existen tres orbitales tipo p, cinco orbitales atómicos tipo d, y siete tipo f. En ellos se van colocando los electrones con spines paralelos en la medida de lo posible. La partícula analizada será más estables ( es decir, tendrá menor energía), cuando los electrones se encuentren en modo desapareado, con espines colocados paralelamente, en cambio poseerá mayor energía cuando los electrones se encuentren apareados, es decir los electrones colocados de manera antiparalela o con espines de tipo opuestos. Para poder comprender bien la regla de Hund, es necesario saber que todos los orbitales en una capa deben de encontrarse ocupados al menos por un electrón, antes de que se añada un segundo electrón. Es decir, los orbitales deben estar completos y todos los electrones deben encontrarse en paralelo antes de que el orbital se llene del todo. Cuando el orbital adquiera el segundo electrón, éste debe encontrarse apareado con el anterior.
La regla se basa en el llenado de orbitales atómicos que tengan igual energía, así podemos decir que existen tres orbitales tipo p, cinco orbitales atómicos tipo d, y siete tipo f. En ellos se van colocando los electrones con spines paralelos en la medida de lo posible. La partícula analizada será más estables ( es decir, tendrá menor energía), cuando los electrones se encuentren en modo desapareado, con espines colocados paralelamente, en cambio poseerá mayor energía cuando los electrones se encuentren apareados, es decir los electrones colocados de manera antiparalela o con espines de tipo opuestos. Para poder comprender bien la regla de Hund, es necesario saber que todos los orbitales en una capa deben de encontrarse ocupados al menos por un electrón, antes de que se añada un segundo electrón. Es decir, los orbitales deben estar completos y todos los electrones deben encontrarse en paralelo antes de que el orbital se llene del todo. Cuando el orbital adquiera el segundo electrón, éste debe encontrarse apareado con el anterior.
De esta manera, los electrones de un átomo van añadiéndose de manera progresiva, utilizando una configuración ordenada, con la finalidad de tener buenas condiciones energéticas estables. Así el principio de Aufbau, explica bien las reglas a seguir para el llenado de orbitales para no utilizar mal la regla de Hund. En resumen, como existen orbitales equivalentes, primeramente se completa los electrones al máximo que se pueda y posteriormente se pasa a emparejar.
En cuanto al principio de Aufbau que seguimos para no cometer errores en la regla de Hund, este se basa en un diagrama de orbitales, en donde si seguimos el orden de llenado que nos indican las flechas que en el aparecen, llenaremos correctamente los orbitales. Así, dicho diagrama empieza con el 1s, seguido de 2s, para después subir al valor 2p y bajar de nuevo a 3s, 3p y seguir por 4s, así sucesivamente siguiendo el orden de las flechas. También se le conoce como regla de las diagonales, o del serrucho. Así el orden será: 1s, 2s, 2p, 3p, 4s, 3d, 4p, 5s, 4d, 5p, 6s, 4f, 5d, 6p, etc.
A menudo se suele representar los orbitales a través de un cuadro rectangular, usando flechas hacia arriba o hacia abajo, para designar los electrones con números cuánticos magnéticos de spin con valores +1/2 ó -1/2, respectivamente.
Según la regla de Hund, la cual fue formulada por primera vez en el año 1925, la configuración más estable es la que los electrones se encuentran ocupando orbitales distintos, y con spines que estén orientados paralelamente. La ocupación, u semiocupación de los orbitales se puede comprender de manera sencilla, pues la repulsión electrostática entre los electrones es ínfima. La preferencia por los spines paralelos, se pueden ver justificados solamente sobre la base de un tratamiento de la mecánica ondulatoria.
El principio de exclusión de Pauli es una regla de la mecánica cuántica enunciada por Wolfgang Ernst Pauli en 1925. Establece que no puede haber dos fermiones con todos sus números cuánticos idénticos (esto es, en el mismo estado cuántico) dentro del mismo sistema cuántico. Formulado inicialmente como principio, posteriormente se comprobó que era derivable de supuestos más generales: de hecho, es una consecuencia del teorema de la estadística del espín.
LOGROS SEGUNDO TRIMESTRE
Realizar la marcación en tu cuaderno con "Segundo trimestre" y copia los EBD-DBA, LOGROS Y CONTENIDOS.
EBC-DBA
|
LOGROS
|
CONTENIDOS
|
EBC: Realizo cálculos cuantitativos en cambios
químicos.
DBA: Balancea ecuaciones químicas dadas por el
docente, teniendo en cuenta la ley de conservación de la masa y la
conservación de la carga, al determinar cuantitativamente las relaciones
molares entre reactivos y productos de una reacción (a partir de sus
coeficientes).
|
Explica
a partir de relaciones cuantitativas de las reacciones químicas la formación
de nuevos compuestos
|
CLASES DE REACCIONES QUÍMICAS.
LEYES DE LA CONSERVACIÓN DE LA
MATERIA
|
DBA: Balancea ecuaciones químicas dadas por el
docente, teniendo en cuenta la ley de conservación de la masa y la
conservación de la carga, al determinar cuantitativamente las relaciones
molares entre reactivos y productos de una reacción (a partir de sus
coeficientes).
|
Balancea
ecuaciones químicas teniendo en cuenta
la ley de conservación de la masa y la conservación de la carga.
|
CÁLCULOS ESTEQUIMÉTRICOS
BALANCEO DE ECUACIONES QUÍMICAS
|
EBC: Realizo cálculos cuantitativos en cambios
químicos
|
Determina
cuantitativamente las relaciones molares entre reactivos y productos de una
reacción (a partir de sus coeficientes.
|
REACTIVO LIMITE Y PORCENTAJE DE
PUREZA
|
TABLA PERIÓDICA
LA HISTORIA DE LA TABLA PERIÓDICA
De qué manera pudo el hombre llegar a comprender cómo las sustancias más simples del Universo podían ordenarse, agruparse e incluso, llegar a predecir cuáles faltaban por descubrir?
La actividad científica no es fruto de la casualidad, menos del quehacer de un solo científico por bueno que sea; si bien los hay que han dado un gran impulso al conocimiento, nunca podrán presumir de qué no partieron de lo que otros habían hecho anteriormente.
Griegos, los árabes y la Alquimia
Se cree que en el siglo VII antes de Cristo, Tales de Mileto, filósofo y matemático, afirmó, que todo estaba formado a partir de agua , que en un estado de más o menos ″dureza″, producía cualquier sustancia conocida. Posteriormente Anaxímenes en el siglo VI antes de Cristo creía que aparte del agua, se debería tener en cuenta el aire como sustancia elemental y formadora de otras, no conforme con ésto Heráclito añadió el fuego como elemento
En el siglo V antes de Cristo, Empédocles añadió la tierra como cuarto elemento. De esta manera agua, aire, tierra y fuego combinándose entre sí, formaban todas las sustancias de la naturaleza. Aristóteles, probablemente el filósofo griego que más ha influido en el pensamiento hasta bien entrada la edad moderna, propuso un quinto elemento: el éter, que formaba la materia del Universo fuera de la Tierra: estrellas, planetas etc..
El pensamiento de Aristóteles se difundió en la antigüedad primero a través de Alejandro Magno y sus conquistas que abarcaron desde Grecia hasta la India, luego el Imperio Romano difundió la cultura griega por todo el occidente de Europa (España, Francia, Inglaterra etc.). Al dividirse en dos el Imperio, fueron los bizantinos los mantenedores del pensamiento griego, mientras que la Europa occidental, se sumía en una época donde precisamente no era el pensamiento científico lo que más preocupaba a sus habitantes. Curiosamente fueron los árabes, quienes a través de la conquista de España (siglo VIII d de Cristo), los que volvieron a introducir y propagar el pensamiento de Aristóteles en la Europa occidental.
Durante los siglos VII y VIII, el pensamiento en el mundo musulman absorbe la cultura clásica griega y romana, haciéndola suya. El racionalismo de los griegos y la visión práctica de los romanos son asumidos por el mundo árabe y en lo que concierne a la tecnología, la ciencia y la filosofía, se produce un gran avance, mientras que en el occidente cristiano, se produce un oscurecimiento y olvido de los saberes heredados del mundo romano. Baste como ejemplo, el citado anteriormente: el redescubrimiento de Aristóteles y otros pensadores a través de los árabes.
Se cree que en el siglo VII antes de Cristo, Tales de Mileto, filósofo y matemático, afirmó, que todo estaba formado a partir de agua , que en un estado de más o menos ″dureza″, producía cualquier sustancia conocida. Posteriormente Anaxímenes en el siglo VI antes de Cristo creía que aparte del agua, se debería tener en cuenta el aire como sustancia elemental y formadora de otras, no conforme con ésto Heráclito añadió el fuego como elemento
En el siglo V antes de Cristo, Empédocles añadió la tierra como cuarto elemento. De esta manera agua, aire, tierra y fuego combinándose entre sí, formaban todas las sustancias de la naturaleza. Aristóteles, probablemente el filósofo griego que más ha influido en el pensamiento hasta bien entrada la edad moderna, propuso un quinto elemento: el éter, que formaba la materia del Universo fuera de la Tierra: estrellas, planetas etc..
El pensamiento de Aristóteles se difundió en la antigüedad primero a través de Alejandro Magno y sus conquistas que abarcaron desde Grecia hasta la India, luego el Imperio Romano difundió la cultura griega por todo el occidente de Europa (España, Francia, Inglaterra etc.). Al dividirse en dos el Imperio, fueron los bizantinos los mantenedores del pensamiento griego, mientras que la Europa occidental, se sumía en una época donde precisamente no era el pensamiento científico lo que más preocupaba a sus habitantes. Curiosamente fueron los árabes, quienes a través de la conquista de España (siglo VIII d de Cristo), los que volvieron a introducir y propagar el pensamiento de Aristóteles en la Europa occidental.
Durante los siglos VII y VIII, el pensamiento en el mundo musulman absorbe la cultura clásica griega y romana, haciéndola suya. El racionalismo de los griegos y la visión práctica de los romanos son asumidos por el mundo árabe y en lo que concierne a la tecnología, la ciencia y la filosofía, se produce un gran avance, mientras que en el occidente cristiano, se produce un oscurecimiento y olvido de los saberes heredados del mundo romano. Baste como ejemplo, el citado anteriormente: el redescubrimiento de Aristóteles y otros pensadores a través de los árabes.
En este ambiente de florecimiento del saber se cultivan entre otras, la Alquimia, antecesora de la Química que, aunque no se trataba de una ciencia, si estimuló el avance del conocimiento de las sustancias, algunos procesos (reacciones químicas) y técnicas de purificación de sustancias son debidas a esta época. Palabras tales como alcohol, aldehído, azogue, álcali... son de uso normal hoy en día y tienen su origen en palabras árabes. La misma palabra ″química″ viene también de su predecesora alquimia que a su vez viene del del árabe kēme (kem, كيمياء), que significa 'tierra'.
Debemos a los alquimistas el hecho de que las sustancias se pueden transformar reaccionando entre sí. Pero ellos lo llevaron mucho más lejos: pensaban que cualquier sustancia, usando el procedimiento adecuado, se podía transformar en otra. Esto lo aplicaron al mercurio y se empeñaron en convertirlo en oro. Muchos alquimistas persiguiendo este fin, murieron, pues el mercurio es extremadamente venenoso. Hay estudiosos de la alquimia que distinguen a los verdaderos alquimistas, que buscarían mediante el trabajo y la vida piadosa, llegar a su purificación y otros, que a sabiendas de que practicaban la superchería, lo hacían para engañar a poderosos (algún monarca cayó en el engaño) con el trato de cambiar dinero por conseguir todo el oro que quisieran. Sea como fuere, El hecho es, que la alquimia se practicó hasta más allá del siglo XVII, por ejemplo, el alquimista Henning Brand descubrió el fósforo a mediados del siglo XVII y, el sistema de símbolos que inventaron para representar las sustancias (tal como vimos en el capítulo anterior) se siguió usando hasta finales del siglo XVIII.
Los alquimistas siguieron con el pensamiento de Empédocles y Aristóteles, no contribuyendo en nada a mejorar o innovar el concepto de elemento químico como tal, aunque sin saberlo, como hemos apuntado anteriormente, descubrieron alguno de ellos.
Quizá la contribución más importante de el siglo XVII se debe a Robert Boyle (químico irlandés, 1621-1691) quien en su obra ″El químico escéptico″, define de manera clara el concepto de elemento químico como "ciertos cuerpos primitivos y simples que no están formados por otros cuerpos, ni unos de otros, y que son los ingredientes de que se componen inmediatamente y en que se resuelven en último término todos los cuerpos perfectamente mixtos". En realidad, Boyle lo que intentaba hacer era una crítica racional a los cuatro elementos de la tradición griega. En la cita podemos ya entrever un espíritu racional y moderno: hay sustancias simples que se unen entre sípara formar sustancias más complejas.
Se denomina "Siglo de las Luces" al siglo XVIII porque, durante este corto periodo, ciencias tales como la Física o las Matemáticas avanzaron mucho más que lo que lo habían hecho antes. Pero no solo por ello ya que, se puede decir, que en este siglo nacieron ciencias como la Geología, la Biología, la Paleontología y la misma Química . Racionalismo y empirismo: dos corrientes del pensamiento se aliaron para impulsar el conocimiento, su sistematización y permitieron la aparición de hombres con el afán de descubrir y explicar la naturaleza.
Aunque muchos elementos se conocían de antiguo: oro, plata, cobre, estaño, plomo, mercurio...etc, durante este siglo, se amplía la lista a elementos gasesosos como el oxígeno, el nitrógeno y el hidrógeno.
También en este siglo, el químico francés Antoine Lavoisier (1743-1794), contribuye al desarrollo de la química con su famosa ″Ley de conservación de la masa″, técnicas de análisis y con una lista de ″sustancias simples″ que abarcaba un total de 33 sustancias elementales.
A lo largo del siglo XVIII, las denominadas listas de afinidad química recogieron un nuevo modo de entender la composición química, que aparece claramente expuesto por el ya citado Lavoisier en su obra "Tratado elemental de Química". Todo ello condujo a diferenciar en primer lugar qué sustancias de las conocidas hasta ese momento eran elementos químicos, cuáles eran sus propiedades y cómo aislarlos.
La primera clasificación de elementos conocida fue también propuesta por Lavoisier, quien propuso que los elementos se clasificaran en metales, metaloides y metales de transición. Aunque simple era muy práctica y todavía funciona en la tabla periódica moderna, pero fue rechazada debido a que había muchas diferencias en las propiedades físicas y químicas de cada elemento. Es decir, los elementos estaban clasificados, pero no ordenados.
A finales de siglo el uso de la electricidad posibilitó una nueva técnica para descomponer sustancias: la electrolisis. Mediante ella, se pudieron ir descubriendo paulatinamente los metales alcalinos y alcalinotérreos. Para 1830 la lista de ″sustancias sencillas″ ascendía a 55. Posteriormente, a mediados del siglo XIX, con la invención del espectroscopio, se descubrieron gran cantidad de nuevos elementos: cesio, rubidio, talio... , los gases nobles, las tierras raras. A finales del siglo XIX se descubren los primeros elementos radiactivos: uranio, radio, polonio, por lo que a comienzos del siglo XX se podría decir que prácticamente todos los elementos químicos presentes en la naturaleza (90) se conocía ya.
El descubrimiento de un gran número de nuevos elementos, así como el estudio de sus propiedades, pusieron de manifiesto algunas semejanzas entre ellos, lo que aumentó el interés de los químicos por buscar algún tipo de clasificación que ordenara este mundo de sustancias elementales.
Dalton y los pesos atómicos.
John Dalton, químico inglés que vivió entre 1766 y 1844, para poder explicar las leyes de Lavoisier, así como su idea de lo que era un elemento, propone que cada elemento químico está formado por unidades indivisibles denominadas átomos (palabra que en griego significa ″sin partes″). Cada átomo de un elemento era idéntico al otro y tenía las mismas características, entre ellas el peso, que el átomo de al lado. Aunque cometiendo muchos errores, fue capaz de obtener una relación de los pesos atómicos de cada elemento respecto del que el creía el átomo más ligero (y era verdad) el de hidrógeno. Ya para 1860, la teoría de Dalton era aceptada y en un congreso de químicos en la ciudad de Karlsruhe, se aprobó la primera tabla de pesos atómicos, que permitió ordenar los elementos de una manera sencilla: por el peso de sus átomos..
Francis Dalton
Las Triadas de Döbereiner, la hélice de Charcourtois y las octavaas de Newlands
El primer intento de ordenar y asimismo, agrupar los elementos por criterios químicos y relacionarlo con los pesos atómicos, se debe al químico alemán Johann Wolfgang Döbereiner(1780-1849) quien en 1817 puso de manifiesto el notable parecido que existía entre las propiedades de ciertos grupos de tres elementos, con una variación gradual del primero al último. Posteriormente (1827) señaló la existencia de otros grupos de tres elementos en los que se daba la misma relación (cloro, bromo y yodo;azufre, selenio y teluro; litio, sodio y potasio).
En 1864, el químico inglés John Alexander Reina Newlands observó que si se ponían los elementos en orden creciente de sus pesos atómicos, sin tomar en cuenta al hidrógeno, el octavo elemento a partir de cualquier otro tenía unas propiedades muy similares al primero. En realidad el octavo elemento era un gas noble, pero en aquella época los llamados gases nobles no habían sido aún descubiertos.
Esta ley mostraba una cierta ordenación de los elementos en familias (grupos), con propiedades muy parecidas entre sí, y en periodos, formados por ocho elementos cuyas propiedades iban variando progresivamente.
El nombre de octavas se basa en la intención de Newlands de relacionar estas propiedades con la que existe en la escala de las notas musicales, por lo que dio a su descubrimiento el nombre de ley de las octavas.
Realmente, a partir del calcio dejaban de existir las octavas. La razón es que los elementos de transición vienen a continuación y empiezan los periodos "largos" de la Tabla Periódica. Como a partir del calcio dejaba de cumplirse esta regla, esta ordenación no fue apreciada por la comunidad científica que lo menospreció y ridiculizó, hasta que 23 años más tarde fue reconocido por la Royal Society, que concedió a Newlands su más alta condecoración, la medalla Davy.
Aparece Mendeleiev en nuestra historia
En 1869, el ruso Dimitri Ivanovich Mendeleyev (Medeleew, Mendelejew y otras formas de escribir su nombre en alfabeto latino) publica su primera Tabla Periódica en Alemania. Un año después el quimico alemán Julius Lothar Meyer, que basó su clasificación periódica en la periodicidad de los volúmenes atómicos en función de la masa atómica de los elementos (cosa que parece bastante complicada, de ahí el éxito que tuvo).
Por ésta fecha ya eran conocidos 63 elementos de los 90 que existen en la naturaleza. La clasificación la llevaron a cabo los dos químicos de acuerdo con los criterios siguientes:
• Colocaron los elementos por orden creciente de sus masas (pesos) atómicas.
• Situaron en el mismo grupo elementos que tenían propiedades comunes como la valencia.
.
La primera clasificación periódica de Mendeleyev no tuvo buena acogida al principio. Después de varias modificaciones publicó en el año 1872 una nueva Tabla Periódica constituida por ocho columnas desdobladas en dos grupos cada una, que al cabo de los años se llamaron familia A y B.
En su nueva tabla consigna las fórmulas generales de los hidruros y óxidos de cada grupo y por tanto, implícitamente, las valencias de esos elementos. Esta tabla fue completada a finales del siglo XIX con un grupo más, el grupo cero, constituido por los gases nobles descubiertos durante esos años en el aire. El químico ruso no aceptó en principio tal descubrimiento, ya que esos elementos no tenían cabida en su tabla. Pero cuando, debido a su inactividad química (valencia cero), se les asignó el grupo cero, la Tabla Periódica quedó más completa.
El gran mérito de Mendeleyev consistió en pronosticar la existencia de elementos que aún no habían sido descubiertos. Dejó casillas vacías para situar en ellas los elementos cuyo descubrimiento se realizaría años después. Incluso pronosticó las propiedades de algunos de ellos: el galio (Ga), al que llamó eka-aluminio por estar situado debajo del aluminio; el germanio (Ge), al que llamó eka-sicilio; el escandio (Sc); y el tecnecio (Tc), que sería el primer elemento artificial obtenido en el laboratorio, por síntesis química, en 1937.
LA TABLA PERIÓDICA ACTUAL
Problemas en la Tabla de Mendeleyev
La Tabla Periódica propuesta por Mendeleyev presentaba ciertas deficiencias y más de un problema. En las décadas posteriores, finales del siglo XIX y principios de XX, se producen descubrimientos de más elementos: los denominados gases nobles, las "tierras raras" o lantánidos y elementos radioactivos. A duras penas, la tabla de Mendeleyev podia encajar tantos elementos nuevos. Además, había problemas o incoherencias dentro de la propia tabla, en concreto, la ordenación de los elementos por su peso (masa) atómico y la agrupación a su vez en familias era inviable en los casos telurio–yodo, argón–potasio y cobalto–níquel. En efecto, si se seguía a rajatabla la ordenación por los pesos atómicos se llegaba a absurdos tales como que el teluro sería un halógeno, el argón un metal alcalino, el yodo un anfígeno y el potasio un gas noble. Si por el contrario se agrupaban de acuerdo a su similitud desde el punto de vista químico, el criterio de ordenación de los elemntos no sería el correcto.
La ordenación de los elementos por su número atómico
En 1913 Henry Mosley, haciendo un estudio de espectros de rayos X de sustancias elementales, descubrió que había una relación entre la frecuencia de la radiación emitida y el número de orden del elemento en la Tabla Periódica. De ello dedujo que el número de orden en la tabla era una propiedad intrínseca de los núcleos de los átomos y lo que "distinguía" un elemento de otro no era precisamente su peso (masa) atómico, sino que a diferencia de éste, se trataba de un número entero. Posteriormente, ese número se identificó con el número de protones que tiene el átomo en su núcleo (lo que llamamos número atómico).
Quizá, el golpe definitivo a la ordenación por masas atómicas lo dió el descubrimiento de los isótopos. En efecto, si dos átomos del mismo elemento químico podían tener masas distintas, la masa atómica no podía ser un criterio para ordenar y agrupar a su vez por similitud de sus propiedades químicas.
Durante el primer cuarto del siglo XX Niels Bohr, entre otros, propuso la ordenación por número atómico y la agrupación por familias de propiedades químicas semejantes.
.
La mecánica cuántica, la estructura electrónica de los átomos y la "ley periódica"
Durante el primer tercio del siglo XX se desarrolla una teoría denominada Mecánica Cuántica o Mecánica Ondulatoria que explica la estructura electrónica de los átomos. Es decir, su ordenación en niveles y capas de energía. Esto posibilitó explicar el hecho de que elementos distintos pudieran tener propiedades químicas semejantes y que además esto se diera con cierta periodicidad (como ya habían señalado científicos del siglo XIX y, por supuesto, Mendeleyev). En el capítulo siguiente veremos que la estructura en periodos (filas) y grupos (columnas) , así como el número de éstos, corresponde a la configuración electrónica actual.
La Tabla Periódica actual, su estructura en grupos, periodos y bloques.
La Tabla Periódica actual, también conocida como tabla de Werner-Paneth está formada por los 112 elementos que se conocen (más bien se admiten) actualmente y está constituida por siete periodos (filas) y 18 grupos (columnas), además se suele sacar de la tabla una pequeña tira con dos filas de 10 elementossimplemente por razones prácticas, estos son las llamadas "tierras raras", formada por los grupos de elementos llamados lantánidos y actínidos.
A las columnas de la tabla periódica se les conoce como grupos. Todos los elementos que pertenecen a un grupo tienen la misma valencia química principal, y por ello tienen características o propiedades similares entre sí. Por ejemplo, los elementos en el grupo 1 tienen valencia de 1 (ya veremos que se debe a que tienen un electrón en su último nivel de energía) y todos tienden a perder ese electrón al enlazarse como iones positivos de +1. Los elementos en el último grupo de la derecha son los gases nobles, los cuales tienen, o llena su última capa, o ocho electrones en ella (regla del octeto) y, por ello, son todos extremadamente estables y no forman compuestos.
Actividad No. 20
Consultar aportes de Dmitri Mendeleyer, Henry Moseley, Niels Bohr, Alfred Werner.
CARACTERISTICAS
Los grupos se nombran de izquierda a derecha utilizando cifras árabes, según la última recomendación de la IUPAC (según la antigua propuesta de la IUPAC se utilizaban números romanos y las letras A o B) , los grupos de la tabla periódica son en realidad familias de elementos.
Las filas de la tabla periódica son llamadas períodos. Contrario a como ocurre en el caso de los grupos de la tabla periódica, los elementos que componen una misma fila tienen propiedades diferentes, pero masas similares. Todos los elementos de un período van completando la última capa electrónica a medida que se avanza en él. Siguiendo esa norma, cada elemento se coloca según su configuración electrónica. Por ejemplo: en el primer período solo hay dos miembros: hidrógeno y helio; en él se completa la primera capa electrónica .
La tabla periódica consta en total de 7 períodos.
La tabla también está dividida en cuatro bloques, S, D, P, F que están ubicados en el orden SDP, de izquierda a derecha, y el bloque F sería el formado por lantánidos y actínidos. La nomeclatura tiene que ver con el tipo de orbital(es) que se va llenando.
Actividad No. 21 : aprende los grupos y periodos.
Pasa el cursor por los enlaces de la iquierda que se refieren a los grupos, periodos y bloques de la Tabla Periódica, en la tabla de la derecha perderán su coloración y aparecerán como hundidos. Debajo de la Tabla tienes asimismo los nombres de las familias de elementos, pasando por ellos el cursor obtendrás el mismo efecto.
Se trata de que poco a poco, y de acuerdo al nivel que te marque el profesor, vayas conociendo la Tabla por grupos y reconozcas a qué grupo, periodo, bloque y familia pertenece.
Grupos, periodos y bloques
Grupo 1 (I A) :Metalesalcalinos
Grupo 2(IIA): Metales alcalinotérreos
Grupo 3 (III B):Familiadel Escandio
Grupo 4 (IV B): Familia del Titanio
Grupo 5 (V B): Familia del Vanadio
Grupo 6 (VI B): Familia del Cromo
Grupo 7 (VII B): Familia del Manganeso
Grupo 8 (VIII B): Familia del Hierro
Grupo 9 (VIII B): Familia del Cobalto
Grupo 10 (VIII B): Familia del Níquel
Grupo 11 (I B): Familia del Cobre
Grupo 12 (II B): Familia del Zinc
Grupo 13 (III A): Ttérreos
Grupo 14 (IV A): Carbonoideos
Grupo 15 (V A): Nitrogenoideos
Grupo 16 (VI A): Calcógenos o anfígenos
Grupo 17 (VII A): Halógenos
Grupo 18 (VIII A): Gases nobles
Período 1 (2 elementos)
Período 2 ( elementos)
Período 3 (8 elementos)
Periodo4 (18 elementos)
Período 5 (18 elementos)
Período 6 (32 elementos)
Período 7 (26 elementos hasta hoy)
Bloque S
Bloque P
Bloque D
Bloque F
PROPIEDADES PERIÓDICAS
Algunas propiedades de los elementos varían de manera regular por la posición que ocupan en la tabla periódica, razón por la cual se les llama propiedades periódicas. Entre ellas están:
Radio atómico, el potencial de ionización, la afinidad electrónica y la electronegatividad.
Radio atómico: Es una medida del tamaño del átomo. Es la mitad de la distancia existente entre los centros de dos átomos que están en contacto. Aumenta con el periodo (arriba hacia abajo) y disminuye con el grupo (de derecha a izquierda). Entonces el radio atómico dependerá de la distancia al núcleo de los electrones de la capa de valencia.
Energía de ionización: Es la energía requerida para remover un electrón de un átomo neutro. Aumenta con el grupo y diminuye con el período.
Electronegatividad: Es la intensidad o fuerza con que un átomo atrae los electrones que participan en un enlace químico. Aumenta de izquierda a derecha y de abajo hacia arriba.
Afinidad electrónica: Es la energía liberada cuando un átomo neutro captura un electrón para formar un ion negativo. Aumenta de izquierda a derecha y de abajo hacia arriba.
Actividad: Realizar en hojas tamaño oficio una tabla periodica por cada propiedad, donde se observe su variación.
Radio atómico, el potencial de ionización, la afinidad electrónica y la electronegatividad.
Radio atómico: Es una medida del tamaño del átomo. Es la mitad de la distancia existente entre los centros de dos átomos que están en contacto. Aumenta con el periodo (arriba hacia abajo) y disminuye con el grupo (de derecha a izquierda). Entonces el radio atómico dependerá de la distancia al núcleo de los electrones de la capa de valencia.
Energía de ionización: Es la energía requerida para remover un electrón de un átomo neutro. Aumenta con el grupo y diminuye con el período.
Electronegatividad: Es la intensidad o fuerza con que un átomo atrae los electrones que participan en un enlace químico. Aumenta de izquierda a derecha y de abajo hacia arriba.
Afinidad electrónica: Es la energía liberada cuando un átomo neutro captura un electrón para formar un ion negativo. Aumenta de izquierda a derecha y de abajo hacia arriba.
Actividad: Realizar en hojas tamaño oficio una tabla periodica por cada propiedad, donde se observe su variación.
1. Con una X sobre la letra marque
la respuesta correcta una y solo una respuesta:
1. Los
Procesos físicos, actúan sobre la materia:
a. Transformándola b. Cambiando
sus propiedades físicas.
c. No
le cambian sus propiedades
físicas. d. Ninguna
de las anteriores.
2. La
masa es:
a. Cantidad
de materia
b. La
densidad de la materia
c. El
peso de la
materia d. Ninguna
de las anteriores.
3. Son
estados fundamentales de la materia:
a. Sólido
y
líquido b. Gaseoso
y coloidal
c. Sólido,
líquido, gaseoso y
plasma d. Plasma
y coloidal.
4. Los
coloides son:
a. Estados
fundamentales de la
materia b. Estados
intermedios de la materia
c. Estado
vesicular de la
materia d.
Ninguno de los anteriores.
5. En
el estado sólido las fuerzas de las moléculas son:
a. De atracción menor que de
repulsión b. De
atracción igual que de repulsión
c. De repulsión mayor que de
atracción d.
Las fuerzas de las moléculas no existen
6. Sustancias
formadas por la misma clase de átomos de denominan:
a. Moléculas b. Elementos
químicos
c. Compuestos
químicos d. Gases
7. Ductilidad
es la propiedad que presentan los cuerpos para:
a. Dejarse convertir en
láminas b. Combinarse
fácilmente con otro cuerpo
c. Poderse separar por medios
mecánicos d. Dejarse
convertir en hilos.
8. El
número 6,023 X 1023 se denomina Número de:
a. Dalton
b. Lavoiseir
c. Avogadro. d. Proust.
9. Símbolo
es a átomo como fórmula es a:
a. Sustancia
b. Compuesto
c. Elemento
d. Molécula.
10. La base actual para los pesos
atómicos es el átomo de:
a. Carbono-12 b. Oxígeno
c. Hidrógeno
d. Cualquier
elemento.
11. El peso molecular se halla:
a. Dividiendo
el peso entre 6,023X1023
b. Sumando
los pesos atómicos
c. Multiplicando
el peso por 6,023X1023
d. Sumando
el número de Avogadro.
12. Uno de los postulados de
la teoría atómica de Dalton:
a. Átomos
de un elemento son iguales en masa, peso b. El
átomo posee electrones y protones
c. El átomo posee núcleo y
periferia
d. Átomos diferentes dormán
compuestos.
13. En la
tabla periódica moderna la base para la ordenación de los elementos es:
a. El número
masa b. El
número atómico
c. El peso
atómico d. El
estado físico
14. Son elementos
químicos:
a. Carbono, oxígeno, nitrógeno
b. Proteínas y vitaminas
c. Agua y sales minerales.
d. Todas las anteriores.
15. El agua es:
a. Un elemento químico
b. Un compuesto químico
c. Una solución d. Una mezcla
16. El aire es:
a. Un elemento químico
b. Un compuesto químico
b. Una mezcla homogénea
c. Una mezcla heterogénea.
17. La temperatura se mide con:
a. El termómetro
b. La balanza
c. El dinamómetro
d. El barómetro.
18. Decimos que una solución es
sobresaturada cuando:
a. El soluto es mayor que el solvente.
b. El soluto es menor que el solvente
c. Soluto y solvente están en la misma proporción
d. Ninguna de las anteriores.
19. Una sopa de legumbres es:
a. Un elemento químico
b. Un compuesto química
b. Una mezcla homogénea
c. Una mezcla heterogénea.
20. El cambio de estado de gas a
líquido se denomina:
a. Condensación b.
Fusión
c. Sublimación d. Condensación
21. Son métodos corrientes
de separar mezclas:
a. Combustión b. Filtración
c. Centrifugación d. b
y c son correctas
2. A. Identifique como
propiedad física (F) o como propiedad química (Q) lo siguiente:
1. _____ Una botella de gaseosa se empaña
al retirarla de la nevera
2. _____ La gasolina de enciende en los
cilindros de un motor
3. _____ Un clavo de hierro es atraído por
un imán
4. _____ Un helado se derrite cuando se
expone al sol
5. _____ El éter es una sustancia
fácilmente inflamable
6. _____ El agua es incolora
7. _____ Al quemar el papel se transforma
en carbón
8. _____ Juanita tiene los ojos
verdes
9. _____ El alcohol es un líquido de olor
fuerte
10. _____ Los metales en presencia del
oxígeno se oxidan.
2.B. Clasifique
los siguientes cambios como físicos (F) o como químicos (Q)
1. _____ Formación de nubes en la
atmósfera
2. _____ Putrefacción de la carne
3. _____ Fusión del hielo de los casquetes
polares
4. _____ Proceso de la digestión
5. _____ Combustión de la madera
6. _____ Preparar café con leche
7. _____ La carne se volvió carbón
8. _____ Solidificación del agua
9. _____ Ruptura de vasos sanguíneos
10. _____ Incendio forestal.
3. A los conceptos verdaderos
escribe SI y a los falsos la palabra NO.
1. _____ De acuerdo con las últimas
teorías aceptadas, la materia es discontinua.
2. _____ Una molécula es una
partícula neutra constituída por dos o más átomos.
3. _____ El peso de una molécula de
agua es 18 g.
4. _____ El azúcar es una sustancia
pura porque está formada por la misma clase de moléculas.
5. _____ Un trozo de manzana expuesto al
aire se ennegrece, esto indica que se ha llevado a
cabo una reacción química.
6. _____ El peso y la masa son
propiedades físicas de la materia, por lo tanto pueden variar en
una misma cantidad de diferentes sustancias.
7. _____ Los cambios físicos son
cambios reversibles, mientras que los cambios químicos no.
8. _____ Medir es comparar con una
unidad patrón.
9. _____ Todas las disoluciones son
mezclas
10. _____ Todas las sustancias puras
son homogéneas
11. _____ Ninguna mezcla presenta un
aspecto homogéneo.
12. _____ La temperatura el mayor o
menor grado de calor de un cuerpo
13. _____ Una solución es una mezcla heterogénea
14. _____ Energía es la capacidad para realizar un
trabajo
15. _____ Energía potencial es la que poseen los
cuerpos en virtud de su movimiento
16. _____ La fórmula para encontrar la energía
cinética es mv2/2
17. _____ Un Ergio es una unidad de energía mayor
que el Julio
18. _____ Las unidades en que se expresa el Julio
son Kg. m2/s2
19. _____ Punto de fusión es la temperatura en el
que un material pasa de sólido a líquido
20. _____ El cambio del estado gaseoso al líquido
requiere aumento de temperatura.
4A. Completa la siguiente tabla con una
X en el cuadro correspondiente
Sustancia
|
Mezcla
|
Sustancia pura
|
||
Heterogénea
|
Homogénea
|
Compuesto
|
Elemento
|
|
Azúcar
|
||||
Agua de
mar
|
||||
Aire
|
||||
Mayonesa
|
||||
Gasolina
|
||||
Hielo
seco
|
||||
Amoniaco
|
||||
Detergente
|
||||
Alambre
de cobre
|
||||
Gas que
expele el exhosto de un auto
|
||||
4B. Calcule el peso molecular de:
(Respuestas con dos cifras decimales). (Pa: K=
39g; H= 1 g; I= 127g; S=32
g; N=14 g; C=12g; O= 16 g;
Cu=64g)
1. KI_____________________________________________________________________________
2. H2SO4_________________________________________________________________________
3. HNO3__________________________________________________________________________
4. CH4___________________________________________________________________________
5. CuSO4 ________________________________________________________________________
4B. Utilizando los pesos moleculares del ejercicio anterior calcule el peso en gramos de:
1. 4,2 moles de KI
__________________________________________________________________________________
2. 1,5 moles de H2SO4
__________________________________________________________________________________
3. 0,9 moles de HNO3
__________________________________________________________________________________
4. 2 moles de CH4
__________________________________________________________________________________
5. 3,5 moles de CuSO4
___________________________________________________________________________________
5. A. Escriba
como se llama los siguientes cambios y si se requiere aumento o disminución de
temperatura:
a. Sólido a líquido:
___________________________La temperatura _____________________.
b. Líquido a gas:
___________________________La temperatura _____________________
c. Gas a
sólido:
___________________________La temperatura _____________________ .
d. Líquido
a sólido: ___________________________La temperatura
_____________________.
e. Gas a líquido:
___________________________La temperatura _____________________
5. B. Observa con atención los esquemas que representan modelos de sólidos, líquidos y gases. Luego, compara las propiedades de cada estado de acuerdo con los siguientes criterios:
Completa la siguiente tabla:
Aspecto
|
Estado
sólido
|
Estado
líquido
|
Estado
gaseoso
|
Ordenamiento
de las partículas
|
|||
Movimiento
|
|||
Cercanía
de las partículas
|
|||
Fuerzas
intermoleculares
|
|||
Volúmen
y forma
|
5. C. Un cuerpo de 1,5 kg de
masa cae desde una altura de 60 m. Determinar la energía potencial
____________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
5. D. La
hipotermia es una condición causada por pérdida de calor corporal. Cuando la
temperatura del cuerpo desciende por debajo de 85oF puede sobrevenir
la muerte por fallas cardiacas. Convierta a grados Celsius y a grados kelvin.
_________________________________________________________________________________________________________________________________________________
Compara los modelos atómicos de Dalton, Thomson y Rutherford, y escribe cinco deiferencias.
ASPECTO
|
MODELO
ATOMICO DALTON
|
MODELO
ATOMICO THOMSON
|
MODELO
ATOMICO RUTHERFORD
|
En lo que has estudiado de química
escribe cinco aspectos de ella que hayas aplicado en tu vida diaria: Justifica
tu respuesta.
________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
Escribe cinco razones
por la cual creas que debes estudiar química y explica tu respuesta.
_______________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________.
_______________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________.
http://cienciaaldia2011.webnode.es/quimica-901/i-periodo/talleres/taller-de-repaso/
REGLA DE LOS NÚMEROS DE OXIDACIÓN
Observe el siguiente video
A continuación tienes las normas que se aplican para la determinación del número de oxidación de los átomos de un compuesto. Recuerda que el número de oxidación es necesario para determinar, en una reacción de oxidación reducción, qué elemento se está oxidando (semirreacción de oxidación) y qué elemento se está reduciendo (semirreacción de reducción).
1. El número de oxidación de un elemento libre es cero. Por ejemplo los metales no disueltos (Cu, Zn, Al…) o los gases diatómicos (O2, Cl2, F2…).
2. En los iones de un único átomo, el estado de oxidación o número de oxidación de dicho átomo coincide con la carga del ión.
Por ejemplo, en el caso de los alcalinos catiónicos el estado de oxidación es +1 (Li+, Na+, K+…) y en el caso de los alcalinotérreos +2 (Ca+2, Mg+2…). Del mismo modo será para los demás metales, por ejemplo, en el Fe(II) el estado de oxidación es +2 y en el Fe(III) +3.
3. El número de oxidación del flúor, F, es siempre -1, por ser el átomo más electronegativo que existe.
4. El número de oxidación del oxígeno es siempre -2, con dos excepciones:
1. Cuando el oxígeno se combina con flúor, su número de oxidación es +2.
2. Cuando el oxígeno se halla formando un peróxido, como el peróxido de hidrógeno o agua oxigenada, H2O2, su número de oxidación es -1.
5. El número de oxidación del hidrógeno es siempre +1, excepto en los hidruros metálicos que es -1 (por ejemplo hidruro sódico, HNa).
6. Algunos elementos tienen distinto estado de oxidación en función del compuesto que están formando. Por ejemplo, el estado de oxidación del nitrógeno en el monóxido de nitrógeno, NO, es +2, mientras que el estado de oxidación del nitrógeno en el dióxido de nitrógeno, NO2, es +4.
7. La suma algebraica de los números de oxidación de los elementos de un compuesto ha de ser igual a su carga, es decir:
a. Si es un compuesto neutro, la suma algebraica de sus números de oxidación será cero.
b. Si es un catión o un anión será igual a la carga del ión. Por ejemplo, en el caso del anión perclorato, ClO3–, la suma algebraica de los números de oxidación será -1. En este caso, el oxígeno tiene estado de oxidación -2, por lo que (-2)·3 = -6. De este modo, para que la suma algebraica sea -1, el estado de oxidación del cloro ha de ser +5.
1. Realice resumen de las reglas de oxidación mencionadas anteriormente.
2. Ingrese a la plataforma educaplay, debe estar registrado y resolver el crucigrama que se encuentra en éste link. https://es.educaplay.com/recursos-educativos/5482623-estados_de_oxidacion.html.
ACTIVIDAD No. 23:
Utilizando la tabla periódica, completa el siguiente cuadro, asignando los números de oxidación de los compuestos y totaliza
https://es.educaplay.com/recursos-educativos/5482623-estados_de_oxidacion.html
ACTIVIDAD LÚDICA
A continuación encontrará una breve sinópsis sobre la historia de la Química a través de los años ó siglos.
Actividad a realizar: En grupos de 4 estudiantes, deberán escoger un periodo de la historia de la química de los expuestos a continuación , consultar un poco más sobre los acontecimientos de cada periodo y realizar una representación, que será grabada para mostrarsela a sus compañeros.
Dicha Grabación debe contener:
Vesuario
Libreto ó guion
Personajes claramente representados con su debido aporte
Tiempo de duración de la grabación: 10 a15 min
Fecha de presentación. Jueves 19 de Mayo (1002)
SINÓPSIS SOBRE LA HISTORIA DE LA QUIMICA
TIEMPOS PRIMITIVOS
- CHINA. 2000 a.c : en la dinastía de Ju, ya los chinos elaboraba la seda artificial, conocimiento que paso luego al Japón, se extendió por Asia, y a principios de nuestra era se desarrolló en Europa.
También los chinos fabricaban el papel, la pólvora, la porcelana; practicaban pinturas sobre telas, bronce o madera.
- EGIPTO: la química entre los egipcios se caracterizó por un aspecto eminente práctico. Era ejercida a manera de ritos religiosos, en la forma secreta y por personas elegidas, sus laboratorios funcionaban anexos a los templos.
Para algunos, la palabra química se deriva de Quemia, antiguo nombre de Egipto; según otros, química significa arte negro, ciencia del misterio.
Los egipcios trabajaban los metales, la pintura, la alfarería, fabricaban tejidos, el vidrio, el jabón; utilizaban la cal en sus construcciones.
Con gran perfección embalsamaban los cadáveres; como agente detergente usaron la trona (carbonato de sodio natural); de las cenizas de la madera extraían la potasa (carbonato de potasio).
- GRECIA: cabe notar, que mientras los egipcios dieron a la química un aspecto práctico, los griegos en cambio se enrumbaron por el lado práctico de la filosofía especulativa.
Fueron fundadores de la escuela materialista jónica primitiva, en miletos (Asia Menor), tales, Anaximandro y Anaxímenes. El lema de esta escuela era: “de que y de qué modo esta echo el mundo”.
De Asia menor el motivo científico griego se trasladó a Italia (Crotona, Elea y Acragas). Pitágoras fundo en crotonas la primera escuela italiana y en ella sobresalieron, entre otros, Parménides y Zenón de Elea.
TALES DE MILETO: (585 a. de C.): observando que el alimento de animales y plantas es la humedad, concluyo que el origen y esencia de todas las cosas es el agua; tierra, aire, todos los seres y cosas del universo son en última instancia productos de transformación del agua, dijo.
Las materias y la filosofía griegas se iniciaron con Tales.
Otros filósofos griegos fueron: Parménides de Elea, Zenón de Elea, Empédocles, Anaxágoras de clazomene. Leucipo, Demócrito, Epicuro, Aristóteles, etc.
PARMENIDES DE ELEA: (475 a. de C) fundador de la escuela eleática; negó la posibilidad de movimiento y cambio de las cosas, lo que es no puede dejar de ser ni puede cambiar.
ZENON DE ELEA (464 a. de C.). Discípulo de Parménides, negó también el movimiento y las cualidades sensibles de las cosas.
EMPEDOCLES: (445 a. de C.). La materia se nos presenta en cuatro elementos fundamentales, aire, tierra, agua y fuego. Estos cuatro elementos mezclados en proporciones variadas constituyen las cosas del mundo empírico.
ANAXAGORAS DE CLAZOMENE: (428 a. de C). Preparo el camino del atomisismo. Considero que los primeros principios o semillas que componen el universo son infinitos en número y variedad.
LEUCIPO DE MILETO: (430 a. de C.). Es considerado el verdadero fundador el atomisismo. Según el, la sustancia primaria era sólida, increada, indestructible, discontinua y formada por pequeñas partículas materiales, imperceptibles, dotadas de movimiento, con forma determinada, ni se crean ni cambian, ni parecen (los átomos).
DEMOCRITO: (420 a. de C.). Discípulo y compañero de Leucipo, nació en Abdera (Tracia); se le considera como el auténtico fundador del atomisismo.
Los elementos que componen el mundo son dos: átomo y vacío. La materiales eterna; los átomos son invisibles, indivisibles, en número infinito, están en movimiento permanente, chocan entre sí, rebotan y se comunican sus movimientos. De la forma de las partículas dependen las distancias sustancias y sus propiedades.
EPICURO: (341-270 a. de C.) dio nombre de átomo (indivisible). Revivió y apoyo el atomismo de Demócrito. No admite en la naturaleza más que la materia, y descarta la existencia de un dios creador del universo.
ARISTOTELES (384-270 a. de C.). Nació en estagira. Adversario del atomisismo que negó la discontinuidad de la materia y el vacío.
Estableció los modos de manifestarse al tacto los cuatro elementos de Empédocles: lo caliente, lo frio, lo húmedo y lo seco.
A los cuatro elementos de Empédocles, agrego otro, “el éter o quinta esencia”. De naturaleza semiespiritual, eterno y que no está sujeto a cambios. A Aristóteles se deben las primeras tentativas del método experimental en las ciencias; también fue el primero en definir la combinación química.
Fueron fundadores de la escuela materialista jónica primitiva, en miletos (Asia Menor), tales, Anaximandro y Anaxímenes. El lema de esta escuela era: “de que y de qué modo esta echo el mundo”.
De Asia menor el motivo científico griego se trasladó a Italia (Crotona, Elea y Acragas). Pitágoras fundo en crotonas la primera escuela italiana y en ella sobresalieron, entre otros, Parménides y Zenón de Elea.
TALES DE MILETO: (585 a. de C.): observando que el alimento de animales y plantas es la humedad, concluyo que el origen y esencia de todas las cosas es el agua; tierra, aire, todos los seres y cosas del universo son en última instancia productos de transformación del agua, dijo.
Las materias y la filosofía griegas se iniciaron con Tales.
Otros filósofos griegos fueron: Parménides de Elea, Zenón de Elea, Empédocles, Anaxágoras de clazomene. Leucipo, Demócrito, Epicuro, Aristóteles, etc.
PARMENIDES DE ELEA: (475 a. de C) fundador de la escuela eleática; negó la posibilidad de movimiento y cambio de las cosas, lo que es no puede dejar de ser ni puede cambiar.
ZENON DE ELEA (464 a. de C.). Discípulo de Parménides, negó también el movimiento y las cualidades sensibles de las cosas.
EMPEDOCLES: (445 a. de C.). La materia se nos presenta en cuatro elementos fundamentales, aire, tierra, agua y fuego. Estos cuatro elementos mezclados en proporciones variadas constituyen las cosas del mundo empírico.
ANAXAGORAS DE CLAZOMENE: (428 a. de C). Preparo el camino del atomisismo. Considero que los primeros principios o semillas que componen el universo son infinitos en número y variedad.
LEUCIPO DE MILETO: (430 a. de C.). Es considerado el verdadero fundador el atomisismo. Según el, la sustancia primaria era sólida, increada, indestructible, discontinua y formada por pequeñas partículas materiales, imperceptibles, dotadas de movimiento, con forma determinada, ni se crean ni cambian, ni parecen (los átomos).
DEMOCRITO: (420 a. de C.). Discípulo y compañero de Leucipo, nació en Abdera (Tracia); se le considera como el auténtico fundador del atomisismo.
Los elementos que componen el mundo son dos: átomo y vacío. La materiales eterna; los átomos son invisibles, indivisibles, en número infinito, están en movimiento permanente, chocan entre sí, rebotan y se comunican sus movimientos. De la forma de las partículas dependen las distancias sustancias y sus propiedades.
EPICURO: (341-270 a. de C.) dio nombre de átomo (indivisible). Revivió y apoyo el atomismo de Demócrito. No admite en la naturaleza más que la materia, y descarta la existencia de un dios creador del universo.
ARISTOTELES (384-270 a. de C.). Nació en estagira. Adversario del atomisismo que negó la discontinuidad de la materia y el vacío.
Estableció los modos de manifestarse al tacto los cuatro elementos de Empédocles: lo caliente, lo frio, lo húmedo y lo seco.
A los cuatro elementos de Empédocles, agrego otro, “el éter o quinta esencia”. De naturaleza semiespiritual, eterno y que no está sujeto a cambios. A Aristóteles se deben las primeras tentativas del método experimental en las ciencias; también fue el primero en definir la combinación química.
Los conocimientos químicos recopilados en la antigüedad desaparecieron con la quema de la biblioteca de Alejandría (640), pero esta ciencia volvió a renacer con la invasión de los árabes de Egipto y España, ya con el nombre de Alquimia, época que duro hasta el siglo XIII. Los objetivos principales de la alquimia eran buscar la “piedra filosofal”, que debe transformar todos los metales viles en oro, y preparar el “elixir de la larga vida”, con el cual volvieran al cuerpo la salud y la juventud perdidas.
El más famoso alquimista árabe fue Geber, Fabir Ibn Huyyan, en cual considero que todos los metales estaban formados por dos sustancias: el mercurio, que determina la fusibilidad, ductilidad y brillo, y el azufre, responsable de las diferencias modificaciones que sufren los metales bajo la acción del calor.
Esta época se orientó a buscar las propiedades medicinales de las sustancias con el fin de prolongar la vida.
Su iniciador paracelso (Felipe Aurelio Teofrasto) medico suizo que llevo la química a la medicina. Consideraba al hombre como a una combinación química, para él las enfermedades se presentaban cuando esta combinación se alteraba, por lo tanto estas solo se curaban mediante sustancias químicas.
QUÍMICA NEUMÁTICA
Este periodo se caracterizó por el estudio de los gases. Juan Bautista Von Helmont invento la palabra gas y la introdujo en la química (1609) reconoció la existencia del gas carbónico, llamándolo “gas silvestre”
Aparecen en este periodo tres grandes sabios ingleses: Roberto Boyle, Roberto Hooke y Juan Mayorw.
QUIMICA DEL FLOGISTO
Este periodo se caracteriza por el estudio de las combustiones. La teología del flogisto fue desarrollada por el alemán Jorge Ernesto Sthal. Según esta teoría, todos los cuerpos combustibles contienen una sustancia llamada “flogisto” o sustancia del fuego; el arder, los cuerpos eliminan en forma de llama su flogisto, todo metal está formado por el flogisto y el óxido metálico.
En este periodo, el francés Juan Rey dijo que el aumento de peso de los metales al ser calentados era debido a la absorción de aire. Boyle y Mayow reconocieron que la combustión se realiza en presencia de aire; durante ella desaparece una parte de este, y el producto de la combustión es más pesado que el cuerpo sin quemar.
Mayow opino que la combustión y calcinación de los metales en el aire es un fenómeno semejante a la respiración ya que en todos ellos se absorbe del aire cierto gas y queda un residuo gaseoso que no permite que la combustión ni es propio para la respiración.
El último de los químicos del flogisto, Marcker. Descubrió el ácido arsénico.
Scheler (Carlos Guillermo) estableció la composición del aire, descubrió el amoniaco y el ácido sulfhídrico.
Priestley (José 9 estudio los gases de la respiración y de la combustión, descubrió el nitrógeno, el oxígeno, el monóxido de carbono.
Cavendish (Enrique) descubrió el hidrogeno y demostró que en la combustión de este se forma solamente agua.
Este periodo se caracteriza por el estudio de las combustiones. La teología del flogisto fue desarrollada por el alemán Jorge Ernesto Sthal. Según esta teoría, todos los cuerpos combustibles contienen una sustancia llamada “flogisto” o sustancia del fuego; el arder, los cuerpos eliminan en forma de llama su flogisto, todo metal está formado por el flogisto y el óxido metálico.
En este periodo, el francés Juan Rey dijo que el aumento de peso de los metales al ser calentados era debido a la absorción de aire. Boyle y Mayow reconocieron que la combustión se realiza en presencia de aire; durante ella desaparece una parte de este, y el producto de la combustión es más pesado que el cuerpo sin quemar.
Mayow opino que la combustión y calcinación de los metales en el aire es un fenómeno semejante a la respiración ya que en todos ellos se absorbe del aire cierto gas y queda un residuo gaseoso que no permite que la combustión ni es propio para la respiración.
El último de los químicos del flogisto, Marcker. Descubrió el ácido arsénico.
Scheler (Carlos Guillermo) estableció la composición del aire, descubrió el amoniaco y el ácido sulfhídrico.
Priestley (José 9 estudio los gases de la respiración y de la combustión, descubrió el nitrógeno, el oxígeno, el monóxido de carbono.
Cavendish (Enrique) descubrió el hidrogeno y demostró que en la combustión de este se forma solamente agua.
TEORIA ATOMICO-MOLECULAR.
El iniciador de este periodo fue Lavoisier (Antonio Lorenzo), quien introdujo en 1796 el empleo de la balanza en los experimentos químicos, empezando así las investigaciones cuantitativas. Demostró que la materia tiene peso y es indestructible y enuncio su ley de la conservación de la materia; aisló el nitrógeno y el oxígeno y luego combinándolos sintetizo agua.
En este periodo Proust (José Luis) enuncio su ley de las proporciones definidas o constantes.
John Dalton enuncio la ley de las relaciones sencillas, y desarrollo una teoría atómica basándose en la antigua de Leucipo y Demócrito.
Gay-Lussac estudio la relación entre la materia y la energía (fisicoquímica).
Juan Jacobo Berzelius estudio la relación entre el volumen y el peso de los gases (densidad de estos).
Amadeo Avogadro formulo su hipótesis molecular.
LA
RADIACTIVIDAD Y LA FÍSICA ATÓMICA.
Dalton creía con Leucipo y Demócrito que los átomos eran indivisibles, y esta teoría fue aceptada por espacio de una centuria, pero fue perdiendo actividad a raíz de ciertos descubrimientos (siglo XIX), como la teoría iónica de Arrhenius, la batería, rayos X, radioactividad, Etc. Que confirmaron definitivamente la teoría corpuscular y la naturaleza eléctrica de la materia.
Röentgen (Konrad Wilhelm) 1895 efectuando experimentos sobre fluorescencia por rayos catódicos descubrió los rayos X.
Becquerel (Korad Wilhelm) 1896 descubrió que las sales de uranio emiten royos invisibles parecidos a los de Röentgen, los cuales atravesaban materiales normalmente opacos a la luz e impresionaban una placa fotográfica.
Este fenómeno de la radioactividad fue el pilar de la nueva física del siglo XX.
Continuadores de los estudios de Becquerel fueron los esposos Curie (María Slodowska y Pierre Curie), que descubrieron el polonio y el radio (1898). María Curie denomino radioactividad a la propiedad de emisión espontanea de rayos invisibles observada en ciertas sustancias.
Como consecuencia de esta investigación la radioactividad ha cobrado tal desarrollo que hoy constituye una importante rama de la ciencia, en la cual han descollado, entre otros, Lord Kelvin, Thomson, Rutherford, soddy, Etc.
Por otra parte, la física nuclear que esta inicia con el descubrimiento del radio, registra nombres famosos como, Albert Einstein, Walton, Cockcroft, James Chadwick, Otto Hahn, Frist Strassmann Niels Bohr, Enrico Fermi, Compton, Etc.
COMPUESTOS INORGÁNICOS
Los compuestos químicos inorgánicos son sustancia de origen mineral, como el agua, la sal, el plomo, el oro, el oxígeno, el talco y el yeso. Estuvieron en nuestro planeta desde sus orígenes, mucho antes de la aparición de la vida.
La química del siglo XVIII y principios del XIX -que condujo a la teoría atómica, la tabla periódica y la radioquímica- basó sus investigaciones en compuestos inorgánicos sencillos, como gases y sales.
¿CÓMO NOMBRAMOS LOS COMPUESTOS?
Desde el nacimiento de la química moderna, se han fijado normas para designar las sustancias. El conjunto de estas normas se denomina nomenclatura química científica.
Actualmente las nomenclaturas de mayor uso son la nomenclatura tradicional, la estequiometria o racional Y Stock Werner. En el desarrollo de este capítulo se hace uso de la nomenclatura tradicional porque menciona el tipo de compuesto, es aplicable a casi todo compuesto y tiene amplia difusión.
Nombres Comunes
El nombre de muchas sustancias existió en el lenguaje popular antes de cualquier nomenclatura científica. Esas denominaciones se usan en la actualidad para presentaciones comerciales. Para referirse a elementos o compuestos puros siempre se emplean nombre químicos.
Formación de Compuestos Inorgánicos:
Funciones Químicas Inorgánicas:
Una función química es una familia de compuestos con propiedades químicas semejantes. Las funciones químicas inorgánicas son cinco: óxidos, hidróxidos, ácidos, hidruros y sales.
El grupo funcional es el átomo o grupo de átomos que identifica a cada función química. Por ejemplo, el grupo OH es el grupo funcional de los hidróxidos.
NaOH Hidróxido de sodio
Ca(OH)2 Hidróxido de calcio
Reglas para asignar números de oxidación
Al formular los compuestos tendremos en cuenta:
-Todos los elementos no combinados tienen número de oxidación cero.
-El oxígeno actúa con número de oxidación -2 en casi todos sus compuestos. Son excepción los peróxidos, en los cuales es donde actúa con -1.
-El número de oxidación del hidrógeno es +1, excepto en los hidruros metálicos, donde en los cuales e trabaja con -1.
-En toda molécula, la suma algebraica de los números de oxidación afectados por los subíndices correspondientes debe ser cero.
-Un ion poliatómico está formado por varios elementos. La carga neta es la suma algebraica del número de oxidación de los elementos que lo forman, afectados por sus respectivos subíndices.
El nombre de muchas sustancias existió en el lenguaje popular antes de cualquier nomenclatura científica. Esas denominaciones se usan en la actualidad para presentaciones comerciales. Para referirse a elementos o compuestos puros siempre se emplean nombre químicos.
Formación de Compuestos Inorgánicos:
Funciones Químicas Inorgánicas:
Una función química es una familia de compuestos con propiedades químicas semejantes. Las funciones químicas inorgánicas son cinco: óxidos, hidróxidos, ácidos, hidruros y sales.
El grupo funcional es el átomo o grupo de átomos que identifica a cada función química. Por ejemplo, el grupo OH es el grupo funcional de los hidróxidos.
NaOH Hidróxido de sodio
Ca(OH)2 Hidróxido de calcio
Reglas para asignar números de oxidación
Al formular los compuestos tendremos en cuenta:
-Todos los elementos no combinados tienen número de oxidación cero.
-El oxígeno actúa con número de oxidación -2 en casi todos sus compuestos. Son excepción los peróxidos, en los cuales es donde actúa con -1.
-El número de oxidación del hidrógeno es +1, excepto en los hidruros metálicos, donde en los cuales e trabaja con -1.
-En toda molécula, la suma algebraica de los números de oxidación afectados por los subíndices correspondientes debe ser cero.
-Un ion poliatómico está formado por varios elementos. La carga neta es la suma algebraica del número de oxidación de los elementos que lo forman, afectados por sus respectivos subíndices.
ACTIVIDAD No. 23
OBSERVAR EL SIGUIENTE VIDEO SOBRE OXIDOS
https://www.youtube.com/watch?v=4FdLXk1Jv3E
OBSERVAR EL SIGUIENTE VIDEO SOBRE OXIDOS
https://www.youtube.com/watch?v=4FdLXk1Jv3E
ÓXIDOS BASICOS
Son compuestos que resultan de la combinación del oxígeno con cualquier otro elemento. El oxígeno se combina fácilmente con la mayoría de los elementos de la tabla periódica. Agrupamos, entonces, a los óxidos en dos grandes categorías: óxidos básicos y óxidos ácidos, diferentes en cuanto a origen y características.
Los óxidos básicos se forman cuando el elemento que se combina con oxígeno es un metal.
Metal + Oxígeno = Óxido básico
2Ca + O2 = 2CaO
Como su nombre lo indica, los óxidos básicos sometidos a la acción del agua producirán compuestos de carácter básico o alcalino.
Formulación:
Para escribir directamente la fórmula:
-Escribimos los símbolos del metal y del oxígeno.
-Intercambiamos los números de oxidación sin el signo y lo escribimos como subíndices. Si es posible, simplificamos.
ÓXIDOS ÁCIDOS
Resultan de combinar con oxígeno un no metal. Los óxidos no metálicos son gaseosos y al disolverse con el agua forman ácidos.
No metal + oxígeno = óxido ácido
C + O2 = CO2
Formulación:
La fórmula del óxido no métalico se escribe como la de un óxido metálico. Escribimos los símbolos del no metal y del oxígeno. Intercambiamos números de oxidación sin signos y los escribimos como subíndices. Si son pares, se simplifican.
Nomenclatura:
Para nombrarlos se antepone el nombre común anhídrido al nombre del no metal. Para diferenciar varios óxidos del mismo no metal, se usan los prefijos hipo- inferior e hiper- superior y los sufijos -oso e -ico, como se muestra:
ACTIVIDAD No. 25
ENLACE QUÍMICO Y NOMENCLATURA
Comprender la importancia de las formulas químicas, para la representación de las diversas sustancias.
1. 1. Resolver de manera individual el siguiente taller sobre enlace químico.
2. Nombrar diferentes compuestos e inversamente escribir sus formulas correspondientes, empleado los 3 sistemas de nomenclatura.
3. Resolver de manera individual el siguiente taller sobre nomenclatura química.
1. Observar el siguiente video sobre "HIDRÓXIDOS: https://www.youtube.com/watch?v=2AMIVzzqtPQ&t=661s.
2. Sacar resumen en el cuaderno sobre el video de hidróxidos.
3. Realiza en el cuaderno los ejercicios de tarea "resueltos" que quedan al final del video.
4. Contestar el siguiente formulario Google sobre Hidróxidos: https://forms.gle/81cV9dvDtKYgETW17
Indicaciones:
No olvides dar click en enviar el formulario.
Después de enviarlo te va a salir la opción, ¿Quieres copia de tu formulario? dile que si, porque lo debes tener en tu cuaderno, sea copiado o impreso.
Si sacaste menos de 3,5, favor enviar foto por classroom del formulario corregido.
Conteo de sello:
1. Segundo trimestre
2. Logros
3. Resumen del video de No. oxidación
4. Ejercicios de tarea del video
5. Impresión del crucigrama
6. Resumen video de hidróxidos
7. Ejercicios de tarea que quedan al final (6)
8. Impresión o corrección del formulario
LOS HIDRÓXIDOS
También llamados bases o alcális, se producen cuando los óxidos básicos o metálicos reaccionan con agua. Su grupo funcional es el radical oxidrilo o hidroxilo OH.
Óxido básico + agua = hidróxido
Na2O + H2O = 2NaOH
Óxido básico + agua = hidróxido
Na2O + H2O = 2NaOH
Los hidróxidos son fácilmente identificables:
-Viran el color del papel tornasol de rojo a azul, y la fenolftaleína de incolora a rojo grosella.
-Tienen sabor amargo, como el jabón o el champú. Pero como regla ¡no pruebes las sustancias químicas!
Formulación:
Para escribir las fórmulas de los hidróxidos procedemos de la siguiente manera:
-Escribimos el símbolo del metal seguido del radical oxidrilo OH.
-Intercambiamos los números de oxidación y los escribimos como subíndices. El número de oxidación del radical oxidrilo es -1.
-El radical oxidrilo se escribe entre paréntesis solo si requiere subíndices.
Nomenclatura:
Los hidróxidos se nombran con ese nombre genérico seguido por el nombre del metal correspondiente.
Si el metal tiene dos posibles estados de oxidación, sus hidróxidos terminan en -oso e -ico, respectivamente:
Pb(OH)2 Hidróxido plumboso
Pb(OH)4 Hidróxido plúmbico
ACTIVIDAD No.28
VVIDEO SOBRE ÁCIDOS Y CLASES DE ÁCIDOS
Video de apoyo
https://www.youtube.com/watch?v=T5ehBeGHbAs
Actividades:
Observar el siguiente video sobre Ácidos y clases de ácidos
2. Sacar resumen en el cuaderno sobre el video de ácidos
3. Contestar el siguiente formulario Google: https://forms.gle/HN6mdW7zFHJHVXi87
Indicaciones:
No olvides dar click en enviar el formulario.
Debes tener en tu cuaderno copia del formulario, sea copiado o impreso.
Si sacaste menos de 3,5, favor enviar foto por classroom del formulario corregido.
Conteo de sello:
1. Segundo trimestre
2. Logros
3. Resumen del video de No. oxidación
4. Ejercicios de tarea del video
5. Impresión del crucigrama
6. Resumen video de hidróxidos
7. Ejercicios de tarea que quedan al final (6)
8. Impresión o corrección del formulario de hidróxidos
9. Resumen de Ácidos
10. Impresión o copia del formulario.
Video de apoyo
https://www.youtube.com/watch?v=T5ehBeGHbAs
Actividades:
Observar el siguiente video sobre Ácidos y clases de ácidos
2. Sacar resumen en el cuaderno sobre el video de ácidos
3. Contestar el siguiente formulario Google: https://forms.gle/HN6mdW7zFHJHVXi87
Indicaciones:
No olvides dar click en enviar el formulario.
Debes tener en tu cuaderno copia del formulario, sea copiado o impreso.
Si sacaste menos de 3,5, favor enviar foto por classroom del formulario corregido.
Conteo de sello:
1. Segundo trimestre
2. Logros
3. Resumen del video de No. oxidación
4. Ejercicios de tarea del video
5. Impresión del crucigrama
6. Resumen video de hidróxidos
7. Ejercicios de tarea que quedan al final (6)
8. Impresión o corrección del formulario de hidróxidos
9. Resumen de Ácidos
10. Impresión o copia del formulario.
ACTIVIDAD No.29
Video de apoyo
https://www.youtube.com/watch?v=T5ehBeGHbAs
Concepto
LOS ÁCIDOS
Son compuestos químicos que tienen al ion hidrógeno H* como grupo funcional. Las características que nos permiten reconocerlos son:
-Viran a rojo el papel tornasol azul.
-Tiene sabor agrio. Puedes experimentarlo con limón o vinagre nunca con ácidos de laboratorio.
-Tienen olor penetrante e irritan la piel y mucosas.
-En soluciones acuosas, se disocian liberando iones hidrógeno (H*) o protones.
Existen dos clases de ácidos inórgánicos: Los ácidos oxácidos, que contienen oxígeno; y los ácidos hidrácidos, que no contienen oxígeno.
Los ácidos oxácidos resultan de la combinación de un óxido ácido o anhídrido con agua.
Óxido Ácido + Agua = Ácido Oxácido
SO3 + H2O = H2SO4
Formulación:
Para escribir la ecuación de formación de un ácido oxácido, partimos del óxido respectivo. Luego simplificamos los subíndices del producto para obtener la fórmula final del ácido acompañada del coeficiente que balancea la ecuación (¡exactamente como extraer múltiplo común!).
Cl2O + H2O = H2Cl2O2 = 2HClO
Nomeclatura:
Para nombrar los ácidos, de nuevo debemos tener en cuenta el número de oxidación del no metal. En la nomenclatura tradicional, el ácido se llama como el anhídrido que lo originó. Solo varía el nombre genérico de anhídrido a ácido, y se mantienen los prefijos y sufijos correspondientes.
HClO Ácido hipocloroso
Los hidrácidos son ácidos no oxigenados porque no provienen de óxidos. Están formados por los metales de los grupos VI A o VII A de la tabla periódica e hidrógeno. Se presentan disociados en soluciones acuosas.
No Metal + Hidrógeno = Ácido Hidrácido
S + H2 = H2S(ac)
Formulación:
Para escribir su fórmula, escribe el símbolo del hidrógeno y el del no metal con número de oxidación negativo; -1 para los del grupo VII A, y -2 si pertenece al grupo VIII A. Intercambia los números de oxidación, sin signos. La abreviatura (ac) indica que el ácido permanece disociado en solución acuosa.
Nomenclatura:
Toman el nombre genérico ácido, seguido del nombre del no metal terminado en el sufijo -hídrico.
HCL Ácido clorhídrico
HBr Ácido bromhídrico
ALGUNOS OTROS EJEMPLOS
TERCER TRIMESTRE
Describe técnicas biotecnológicas como la fertilización asistida, clonación reproductiva y terapéutica, modificación genética, terapias génicas y sus efectos en los organismos.
Explica los usos de la biotecnología y sus efectos en diferentes contextos salud, agricultura, producción energética y ambiente.
Identifica las características que se requieren para el uso de transgénicos y la clonación.
CONTENIDOS
BIOTECNOLOGÍA
ACTIVIDAD No. 30
HIDRUROS
OBSERVAR EL SIGUIENTE VIDEO Y TOMAR IDEAS PRINCIPALES
www.youtube.com/watch?v=B1GZY4SQrkI
HIDRUROS
OBSERVAR EL SIGUIENTE VIDEO Y TOMAR IDEAS PRINCIPALES
www.youtube.com/watch?v=B1GZY4SQrkI
¿Que son los Hidruros?
Un Hidruro es una molécula binaria que posee un metal (o un no metal) unido a un átomo de hidrogeno. Existen dos tipos de hidruros: metálicos y no metálicos.
Hidruros metálicos
Aquellos hidruros formados por hidrógeno y un metal. En estos hidruros el hidrógeno siempre tiene número de oxidación -1 y los metales números de oxidación positivos. Se nombran con la palabra hidruro de
Fórmula general: MHx (M es un metal y x = número de oxidación del metal)
NaH
Monohidruro de sodio
Hidruro de sodio
NiH3
Trihidruro de níquel
Hidruro de Níquel(III)
PbH3
Trihidruro de plomo
Hidruro de Plomo(III)
Hidruro Plumboso
Hidruros no metálicos
Aquellos hidruros formados por hidrógeno y un no metal. En estos, el hidrógeno siempre posee un número de oxidación +1 y los no metales, el menor de sus números de oxidación y con signo negativo. La fórmula general es HnN (N es el no metal y n es el nº de oxidación del no metal)
Ejemplos
NH3
Amoníaco (nombre más usado) o trihidruro de nitrógeno
AsH3
Arsina o trihidruro de arsénico
CH4
Metano (nombre más usado) o tetrahidruro de carbono
H2O
Agua (nombre más usado) o dihidruro de oxígeno
ACTIVIDAD No. 31
OBSERVAR EL SIGUIENTE VIDEO SOBRE SALES
www.youtube.com/watch?v=lonv1Zlkq1I
OBSERVAR EL SIGUIENTE VIDEO SOBRE SALES
www.youtube.com/watch?v=lonv1Zlkq1I
LAS SALES
Son compuestos iónicos sólidos y cristalinos a temperatura ambiente. Abundan en la tierra y en los océanos. Algunas son fundamentales para la vida.
Según el ácido que las originó, las sales pueden ser oxisales o sales haloideas. Algunos ejemplos del uso de las sales en el día a día: la sal común cloruro de sodio, adereza y preserva los alimentos. El mármol carbonato de calcio cristalino. La piedra caliza, las conchas de los moluscos, las perlas y el sarro de la tetera son básicamente la misma sal oxisal.
BALANCEO DE ECUACIONES
Ecuación química
Es la representación gráfica o simbólica de una reacción química que muestra las sustancias, elementos o compuestos que reaccionan (llamados reactantes o reactivos) y los productos que se obtienen. La ecuación química también nos muestra la cantidad de sustancias o elementos que intervienen en la reacción, en sí es la manera de representarlas.
Reacción química
Es también llamado cambio químico y se define como todo proceso químico en el cual una o más sustancias sufren transformaciones químicas. Las sustancias llamas reactantes se combina para formar productos.
En la reacción química intervienen elementos y compuestos. Un ejemplo de ello es el Cloruro de Sodio (NaCl) o comúnmente conocido como "sal de mesa" o "sal común".
La diferencia entre una ecuación y una reacción química es simple: En la ecuación es la representación simbólica lo cual utilizamos letras, símbolos y números para representarla, mientras que en la reacción química es la forma "practica" de la misma (Cuando se lleva a cabo).
Balanceo de una ecuación química
Balancear una ecuación significa que debe de existir una equivalencia entre el número de los reactivos y el número de los productos en una ecuación. Lo cual, existen distintos métodos, como los que veremos a continuación
Para que un balanceo sea correcto: "La suma de la masa de las sustancias reaccionantes debe ser igual a la suma de las
Masas de los productos".
Veremos 3 tipos de balanceo de ecuaciones químicas:
Balanceo por tanteo
Oxido-reducción (redox)
Matemático o algebraico
Ion electrón
BALANCEO POR TANTEO
Para balancear por este o todos los demás métodos es necesario conocer la Ley de la conservación de la materia, propuesta por Lavoisier en 1774. Dice lo siguiente
"En una reacción química, la masa de los reactantes es igual a la masa de los reactivos" por lo tanto "La materia no se crea ni se destruye, solo se transforma"
Como todo lleva un orden a seguir, éste método resulta más fácil si ordenamos a los elementos de la siguiente manera:
Balancear primero
Metales y/o no metales
Oxígenos
Hidrógenos
De esta manera, nos resulta más fácil, ya que el mayor conflicto que se genera durante el balanceo es causado principalmente por los oxígenos e hidrógenos.
Balancear por el método de tanteo consiste en colocar números grandes denominados "Coeficientes" a la derecha del compuesto o elemento del que se trate. De manera que Tanteando, logremos una equivalencia o igualdad entre los reactivos y los productos.
Ejemplo:
Balancear la siguiente ecuación química:
Continuamos: ¿Cuántos oxígenos hay en el primer miembro? Encontramos 4 porque 3 mas 1 es igual a 4
Y ¿Cuántos en el segundo? Encontramos 6 porque el dos (situado a la izquierda del Fe) se multiplica por el subíndice encontrado a la derecha del paréntesis final y se multiplica 2*3 = 6
Por lo tanto en el segundo miembro hay 6 oxígenos.
Entonces colocamos un 3 del lado izquierdo del hidrógeno en el primer miembro para tener 6 oxígenos
Posteriormente, Vamos con los hidrógenos, en el primer miembro vemos que hay 6 hidrógenos y en el segundo igualmente 6.
Entonces concluimos de la siguiente manera:
ACTIVIDAD No. 32
BALANCEO POR EL MÉTODO DE TANTEO
ACTIVIDAD No. 33
TALLER DE REPASO
TALLER DE REPASO
1. Indica si son verdaderos o falsos los siguientes enunciados. Justifica tu respuesta.
_____ Los cambios o transformaciones en la naturaleza suelen ir acompañados de cambios de energía.
_____ El azúcar es una sustancia pura porque está formada por la misma clase de moléculas.
_____ La densidad es una propiedad extensiva porque depende de la cantidad de materia de la sustancia.
_____ Un trozo de manzana expuesto al aire se ennegrece, esto indica que se lleva a cabo una reacción química.
_____ El peso y la masa son propiedades físicas de la materia, por lo tanto pueden variar en una misma cantidad de diferentes sustancias.
_____ Los cambios físicos son cambios reversibles, mientras que los cambios químicos no.
2. Señala algunas diferencias y semejanzas entre:
a. Sustancias puras y mezclas
b. Propiedades extrínsecas e intrínsecas
c. Cambios físicos y cambios químicos
d. Masa y peso
e. Elemento y compuesto.
3. Relaciona el enunciado con el concepto correspondiente.
a) Cantidad de materia.
b) Las mezclas de gases resultan siempre...
c) La energía gravitatoria es un tipo de energía...
d) Sustancias que se descomponen en otras más sencillas.
e) Transformación de una sustancia en otra.
f) Método de separación de fases, empleado cuando las partículas tienen diferente tamaño.
g) Estado de agregación en que la materia es fácilmente compresible.
h) Sustancia química que volatiliza y sublima.
i) Paso del estado gaseoso al líquido.
j) Zona del átomo donde se encuentran los protones y los neutrones.
k) Propiedades que dependen de la cantidad de materia en estudio.
l) Partículas subatómicas con carga positiva.
m) Aparato empleado para separar un líquido de un sólido mediante la aplicación de altas velocidades.
n) Reacción química que libera calor.
ñ) Sistema que no intercambia materia ni energía con el exterior.
4. Diseña un procedimiento para separar los componentes de las siguientes mezclas, e indica qué material de laboratorio necesitarías.
a) Una mezcla de aserrín y azúcar.
b) Una mezcla heterogénea de tres líquidos no miscibles: agua, aceite y mercurio.
c) Una mezcla de sal y azúcar.
d) Una mezcla de harina y limadura de hierro.
5. Indica cuál de los siguientes procedimientos es el más adecuado para separar una mezcla de sal, azufre y gasolina. Justifica tu elección y explica por qué rechazas cada uno de los otros.
a) Calentar para que la gasolina se evapore y separar después la sal y el azufre añadiendo agua. Al filtrar quedaría el azufre en el papel y se separaría la sal del agua por evaporación del agua.
b) Filtrar para separar la gasolina de los sólidos. Añadir agua sobre el mismo filtro para que se disuelva la sal y separarla del azufre por filtración. Recuperarla dejando evaporar el agua.
c) Filtrar para separar la gasolina de los dos sólidos. Añadir sulfuro de carbono sobre el filtro para disolver el azufre y luego por evaporación el sulfuro de carbono.
d) Calentar para que primero se evapore la gasolina y después se funda el azufre.
6. Señala cuáles de los siguientes procesos son cambios físicos y cuáles cambios químicos.
a) Vaporización del agua.
b) Mezcla en un recipiente de dos gases, oxígeno hidrógeno.
c) Formación de agua al hacer saltar una chispa eléctrica en una mezcla de oxígeno e hidrógeno
d) Oxidación del hierro.
e) Calentamiento de un trozo de aluminio.
1. Con una X sobre la letra marque la respuesta correcta una y solo una respuesta:
1. Los Procesos físicos, actúan sobre la materia:
a. Transformándola b. Cambiando sus propiedades físicas.
c. No le cambian sus propiedades físicas. d. Ninguna de las anteriores.
2. La masa es:
a. Cantidad de materia b. La densidad de la materia
c. El peso de la materia d. Ninguna de las anteriores.
3. Son estados fundamentales de la materia:
a. Sólido y líquido b. Gaseoso y coloidal
c. Sólido, líquido, gaseoso y plasma d. Plasma y coloidal
4. Los coloides son:
a. Estados fundamentales de la materia b. Estados intermedios de la materia
c. Estado vesicular de la materia d. Ninguno de los anteriores.
5. En el estado sólido las fuerzas de las moléculas son:
a. De atracción menor que de repulsión b. De atracción igual que de repulsión
c. De repulsión mayor que de atracción d. Las fuerzas de las moléculas no existen
6. Sustancias formadas por la misma clase de átomos de denominan:
a. Moléculas b. Elementos químicos
c. Compuestos químicos d. Gases
7. Ductilidad es la propiedad que presentan los cuerpos para:
a. Dejarse convertir en láminas b. Combinarse fácilmente con otro cuerpo
c. Poderse separar por medios mecánicos d. Dejarse convertir en hilos.
8. El número 6,023 X 1023 se denomina Número de:
a. Dalton b. Lavoiseir
c. Avogadro d. Proust.
9. Símbolo es a átomo como fórmula es a:
a. Sustancia b. Compuesto
c. Elemento d. Molécula.
10. La base actual para los pesos atómicos es el átomo de:
a. Carbono-12 b. Oxígeno
c. Hidrógeno d. Cualquier elemento.
11. El peso molecular se halla:
a. Dividiendo el peso entre 6,023X1023 b. Sumando los pesos atómicos
c. Multiplicando el peso por 6,023X1023 d. Sumando el número de Avogadro
12. Uno de los postulados de la teoría atómica de Dalton:
a. Átomos de un elemento son iguales en masa, peso b. El átomo posee electrones y protones
c. El átomo posee núcleo y periferia d. Átomos diferentes dormán compuestos
13. . En la tabla periódica moderna la base para la ordenación de los elementos es:
a. El número masa b. El número atómico
c. El peso atómico d. El estado físico
14. Son elementos químicos:
a. Carbono, oxígeno, nitrógeno b. Proteínas y vitaminas
c. Agua y sales minerales. d. Todas las anteriores
15. El agua es:
a. Un elemento químico b. Un compuesto químico
c. Una solución d. Una mezcla
16. El aire es:
a. Un elemento químico b. Un compuesto químico
b. Una mezcla homogénea c. Una mezcla heterogénea
17. La temperatura se mide con:
a. El termómetro b. La balanza
c. El dinamómetro d. El barómetro.
18. Decimos que una solución es sobresaturada cuando:
a. El soluto es mayor que el solvente. b. El soluto es menor que el solvente
c. Soluto y solvente están en la misma proporción d. Ninguna de las anteriores
19. Una sopa de legumbres es:
a. Un elemento químico b. Un compuesto química
b. Una mezcla homogénea c. Una mezcla heterogénea
20. El cambio de estado de gas a líquido se denomina:
a. Condensación b. Fusión
c. Sublimación d. Condensación
21. Son métodos corrientes de separar mezclas:
a. Combustión b. Filtración
c. Centrifugación d. b y c son correctas
2. A. Identifique como propiedad física (F) o como propiedad química (Q) lo siguiente:
1. _____ Una botella de gaseosa se empaña al retirarla de la nevera
2. _____ La gasolina de enciende en los cilindros de un motor
3. _____ Un clavo de hierro es atraído por un imán
4. _____ Un helado se derrite cuando se expone al sol
5. _____ El éter es una sustancia fácilmente inflamable
6. _____ El agua es incolora
7. _____ Al quemar el papel se transforma en carbón
8. _____ Juanita tiene los ojos verdes
9. _____ El alcohol es un líquido de olor fuerte
10. _____ Los metales en presencia del oxígeno se oxidan
2.B. Clasifique los siguientes cambios como físicos (F) o como químicos (Q)
1. _____ Formación de nubes en la atmósfera
2. _____ Putrefacción de la carne
3. _____ Fusión del hielo de los casquetes polares
4. _____ Proceso de la digestión
5. _____ Combustión de la madera
6. _____ Preparar café con leche
7. _____ La carne se volvió carbón
8. _____ Solidificación del agua
9. _____ Ruptura de vasos sanguíneos
10. _____ Incendio forestal
3. A los conceptos verdaderos escribe SI y a los falsos la palabra NO
1. _____ De acuerdo con las últimas teorías aceptadas, la materia es discontinua.
2. _____ Una molécula es una partícula neutra constituída por dos o más átomos.
3. _____ El peso de una molécula de agua es 18 g.
4. _____ El azúcar es una sustancia pura porque está formada por la misma clase de moléculas.
5. _____ Un trozo de manzana expuesto al aire se ennegrece, esto indica que se ha llevado a cabo una reacción química.
6. _____ El peso y la masa son propiedades físicas de la materia, por lo tanto pueden variar en una misma cantidad de diferentes sustancias.
7. _____ Los cambios físicos son cambios reversibles, mientras que los cambios químicos no.
8. _____ Medir es comparar con una unidad patrón.
9. _____ Todas las disoluciones son mezclas
10. _____ Todas las sustancias puras son homogéneas
11. _____ Ninguna mezcla presenta un aspecto homogéneo.
12. _____ La temperatura el mayor o menor grado de calor de un cuerpo
13. _____ Una solución es una mezcla heterogénea
14. _____ Energía es la capacidad para realizar un trabajo
15. _____ Energía potencial es la que poseen los cuerpos en virtud de su movimiento
16. _____ La fórmula para encontrar la energía cinética es mv2/2
17. _____ Un Ergio es una unidad de energía mayor que el Julio
18. _____ Las unidades en que se expresa el Julio son Kg. m2/s2
19. _____ Punto de fusión es la temperatura en el que un material pasa de sólido a líquido
20. _____ El cambio del estado gaseoso al líquido requiere aumento de temperatura
4A. Completa la siguiente tabla con una X en el cuadro correspondiente
Sustancia
|
Mezcla
|
Sustancia pura
|
||
Heterogénea
|
Homogénea
|
Compuesto
|
Elemento
|
|
Azúcar
|
||||
Agua de mar
|
||||
Aire
|
||||
Mayonesa
|
||||
Gasolina
|
||||
Hielo seco
|
||||
Amoniaco
|
||||
Detergente
|
||||
Alambre de cobre
|
||||
Gas que expele el exhosto de un
auto
|
||||
4B. Calcule el peso
molecular de: (Respuestas con dos cifras decimales).
(Pa: K= 39g; H= 1 g; I=
127g; S=32 g; N=14 g; C=12g; O=
16 g; Cu=64g)
1. KI_______________________________________________________________________________________________________________________________________________________________________________________________________________________________
2. H2SO4___________________________________________________________________________________________________________________________________________________________________________________________________________________________
3. HNO3____________________________________________________________________________________________________________________________________________________________________________________________________________________.
4. CH4_____________________________________________________________________________________________________________________________________________________________________________________________________________________________
5. CuSO4 _______________________________________________________________________________________________________________________________________________________________________________________________________________________________
4C. Utilizando los pesos moleculares del ejercicio anterior calcule el
peso en gramos de:
1. 4,2 moles de KI____________________________________________________
1,5 moles de H2SO4__________________________________________________________________________
1,5 moles de H2SO4__________________________________________________________________________
4. 2 moles de CH4______________________________________________________________
5. 3,5 moles de CuSO4___________________________________________________________
5.A. Escriba como se llama los siguientes cambios y si se requiere aumento o disminución de temperatura:
a) Calentar para que la gasolina se evapore y separar después la sal y el azufre añadiendo agua. Al filtrar quedaría el azufre en el papel y se separaría la sal del agua por evaporación del agua.
b) Filtrar para separar la gasolina de los sólidos. Añadir agua sobre el mismo filtro para que se disuelva la sal y separarla del azufre por filtración. Recuperarla dejando evaporar el agua.
c) Filtrar para separar la gasolina de los dos sólidos. Añadir sulfuro de carbono sobre el filtro para disolver el azufre y luego por evaporación el sulfuro de carbono.
d) Calentar para que primero se evapore la gasolina y después se funda el azufre.
5.B. Observa con atención los esquemas que representan modelos de sólidos, líquidos y gases. Luego, compara las propiedades de cada estado de acuerdo con los siguientes criterios:
Completa la siguiente tabla:
Aspecto
|
Estado
sólido
|
Estado
líquido
|
Estado
gaseoso
|
Ordenamiento de las partículas
|
|||
Movimiento
|
|||
Cercanía de las partículas
|
|||
Fuerzas intermoleculares
|
|||
Volúmen y forma
|
5. C. Un cuerpo de 1,5 kg de masa cae desde una altura de 60
m. Determinar la energía potencial Ep= m..g.h (gravedad 9.8 m/s2
__
________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
____________________________________________________________________________________________________________________
____________________________________________________________________________________________________________________
____________________________________________________________________________________________________________________
D. La hipotermia es una
condición causada por pérdida de calor corporal. Cuando la temperatura del
cuerpo desciende por debajo de 85oF puede sobrevenir la muerte por
fallas cardiacas. Convierta a grados Celsius y a grados kelvin.
_ ____________________________________________________________________________________________________________________
____________________________________________________________________________________________________________________
____________________________________________________________________________________________________________________
____________________________________________________________________________________________________________________
____________________________________________________________________________________________________________________
____________________________________________________________________________________________________________________
____________________________________________________________________________________________________________________
____________________________________________________________________________________________________________________
____________________________________________________________________________________________________________________
Compara los modelos atómicos de Dalton, Thomson y Rutherford, y escribe
cinco dIferencias.
ASPECTO
|
MODELO DALTON
|
MODELO THOMSON
|
MODELO RUTHERFORD
|
En lo que has estudiado de química escribe cinco aspectos de ella que
hayas aplicado en tu vida diaria: Justifica tu respuesta.
______________________________________________________________________________________________________________________
____________________________________________________________________________________________________________________
____________________________________________________________________________________________________________________
____________________________________________________________________________________________________________________
____________________________________________________________________________________________________________________
____________________________________________________________________________________________________________________
____________________________________________________________________________________________________________________
____________________________________________________________________________________________________________________
____________________________________________________________________________________________________________________
Escribe cinco razones por la cual creas que debes estudiar química y explica tu respuesta.
____________________________________________________________________________________________________________________
____________________________________________________________________________________________________________________
____________________________________________________________________________________________________________________
____________________________________________________________________________________________________________________
____________________________________________________________________________________________________________________
____________________________________________________________________________________________________________________
____________________________________________________________________________________________________________________
____________________________________________________________________________________________________________________
____________________________________________________________________________________________________________________
SOLUCIONES
SOLUCIONES
https://www.webcolegios.com/file/ed5ce6.pdf
COMPONENTES DE LAS SOLUCIONES
CLASIFICACIÓN DE LAS SOLUCIONES SEGÚN SU CONCENTRACIÓN
https://www.webcolegios.com/file/ed5ce6.pdf
El ángstrom (símbolo Å1) es una unidad de longitud empleada principalmente para expresar longitudes de onda, distancias moleculares y atómicas, etc. Se representa por la letra sueca Å.
Unidad de medida equivalente a la diez mil millonésima parte del metro, 0.000,000,000,1 metros. En un centímetro caben 100 millones de ángstroms. Con lo cual es una medida que casi no se usa y que en ese caso se usaría para medir cosas muy pequeñas.
Su nombre proviene del físico sueco Anders Jonas Ångström.
Unidad de medida equivalente a la diez mil millonésima parte del metro, 0.000,000,000,1 metros. En un centímetro caben 100 millones de ángstroms. Con lo cual es una medida que casi no se usa y que en ese caso se usaría para medir cosas muy pequeñas.
Su nombre proviene del físico sueco Anders Jonas Ångström.
https://es.wikipedia.org/wiki/%C3%85ngstr%C3%B6m
https://www.webcolegios.com/file/ed5ce6.pdf
Link de apoyo para los ejercicios
https://www.youtube.com/watch?v=Lj6AhLLgLDc
https://www.youtube.com/watch?v=qGytaIEc4x4
ACTIVIDAD No. 31
1. Tomar ideas principales en el cuaderno
2. Realizar las tablas en el cuaderno y dar dos ejemplos de cada coloide.3. Realizar los SIGUIENTES ejercicios propuestos sobre soluciones químicas, también serán enviados a su correo electrónico por la plataforma Class-room.
1.
LOS GASES
ESTADO GASEOSO
Los sistemas materiales gaseosos se caracterizan desde un punto de vista MACROSCOPICO por:
• Su homogeneidad
• Su pequeña densidad, respecto de líquidos y sólidos
• La ocupación de todo el volumen del recipiente que los contiene
• la espontánea difusión de un gas en otro, dando soluciones.
La estructura de los gases es interpretada por la teoría cinético-molecular (MICROSCOPICO):
• La sustancia, en estado gaseoso, está constituida por moléculas muy separadas entre sí, como corresponde a su baja densidad.
• Las moléculas están animadas de perpetuo movimiento, trasladándose en línea recta en todas las direcciones y sentidos dentro del volumen ocupado.
• Hay choques de las moléculas contra las paredes del recipiente y también entre si (choques intermoleculares).
• Su homogeneidad
• Su pequeña densidad, respecto de líquidos y sólidos
• La ocupación de todo el volumen del recipiente que los contiene
• la espontánea difusión de un gas en otro, dando soluciones.
La estructura de los gases es interpretada por la teoría cinético-molecular (MICROSCOPICO):
• La sustancia, en estado gaseoso, está constituida por moléculas muy separadas entre sí, como corresponde a su baja densidad.
• Las moléculas están animadas de perpetuo movimiento, trasladándose en línea recta en todas las direcciones y sentidos dentro del volumen ocupado.
• Hay choques de las moléculas contra las paredes del recipiente y también entre si (choques intermoleculares).
PROPIEDAD
|
DESCRIPCIÓN
|
Expansión
|
Se refiere
a que los gases se expanden uniformemente para llenar todo el recipiente que
los contiene.
|
Compresión
|
El volumen
de los gases se puede reducir debido a la acción de presiones externas
sobre sus moléculas.
|
Baja densidad
|
A
diferencia de los sólidos y líquidos, los gases presentan una baja densidad
debido a que el volumen ocupado por un gas consiste principalmente en espacio
vacío. La densidad de los cánceres se expresa en g/l.
|
Difusión
|
la
difusión de la propiedad que tienen los gases para distribuirse uniformemente
por el espacio en el que se encuentran.
|
Además de las antes mencionadas existen otras cuatro propiedades importantes en los gases.
Volumen de un gas: el volumen se define como el espacio ocupado por una sustancia. En el sistema internacional de unidades (SI), la unidad fundamental del volumen es el metro cúbico (m3). Para expresar el volumen de los gases generalmente se emplea el litro (l) y el mililitro (ml).
Presión de un gas: los gases ejercen una presión sobre cualquier superficie con la que estén en contacto. La presión es el resultado de los choques entre las moléculas de un gas y las paredes del recipiente que lo contienen. La magnitud de la presión depende tanto de la frecuencia como de la fuerza con la que las moléculas chocan con las paredes. La presión se define como la fuerza por unidad de área.
Las expresiones de la presión más usadas en química son atmósferas (atm) y milímetros de mercurio (mmHg)
1 atm = 760mmHg
Temperatura: es una medida de la energía cinética (en virtud del movimiento) promedio de todas las moléculas que conforman el material. El calor es una forma de energía que tiene un material y está asociada al movimiento de sus moléculas. Ésa energía se puede transmitir de un material a otro debido a una diferencia de temperatura. Cuando aumentamos la temperatura del material, los átomos y moléculas se mueve más rápido, incrementando su energía cinética o calor. La temperatura no depende del número ni el tamaño de las partículas de un material sino de su velocidad media.
si tienes dudas con la medida de la temperatura puedes ingresar al link y ver el video de unidades de medida.
http://www.investiciencias.com/componentes/quimica-11/154-gases.html?showall=1&limitstart=
Teoría cinético molecular de los gases
Para poder comprender las características y predecir el comportamiento de los gases, se empleó un modelo conocido como teoría cinética, que afirma que el estado y comportamiento de los materiales está directamente relacionado con su estructura interna. Esta teoría plantea que la materia está formada por pequeñas partículas en constante movimiento y el calor es una señal de ese movimiento.
Postulados de la teoría cinética de los gases:
1. Un gas está conformada por una gran cantidad de partículas (moléculas) que se encuentran en continuo movimiento.
2. Cada una de estas partículas posee una energía cinética que depende su temperatura, por esta razón, la temperatura se considera como una medida de la energía cinética promedio de todas las partículas que conforman un material.
3. La distancia entre las moléculas es grande en comparación con el tamaño de las mismas. El volumen ocupado por un gas consiste principalmente en un espacio vacío.
4. Las partículas del gas se mueven continuamente al azar en línea recta chocando rápidamente entre sí unas con otras y contra las paredes del recipiente que las contienen.
Leyes de los Gases
Ley de los gases Ideales
Se han desarrollado leyes empíricas que relacionan las variables macroscópicas con base en las experiencias realizadas en laboratorios. En los gases ideales, estas variables incluyen la presión (P), el volumen (V) y la temperatura (T).
Ley de Boyle - Mariotte relaciona inversamente las proporciones de volumen y presión de un gas, manteniendo la temperatura constante:
Volumen de un gas: el volumen se define como el espacio ocupado por una sustancia. En el sistema internacional de unidades (SI), la unidad fundamental del volumen es el metro cúbico (m3). Para expresar el volumen de los gases generalmente se emplea el litro (l) y el mililitro (ml).
Presión de un gas: los gases ejercen una presión sobre cualquier superficie con la que estén en contacto. La presión es el resultado de los choques entre las moléculas de un gas y las paredes del recipiente que lo contienen. La magnitud de la presión depende tanto de la frecuencia como de la fuerza con la que las moléculas chocan con las paredes. La presión se define como la fuerza por unidad de área.
Las expresiones de la presión más usadas en química son atmósferas (atm) y milímetros de mercurio (mmHg)
1 atm = 760mmHg
Temperatura: es una medida de la energía cinética (en virtud del movimiento) promedio de todas las moléculas que conforman el material. El calor es una forma de energía que tiene un material y está asociada al movimiento de sus moléculas. Ésa energía se puede transmitir de un material a otro debido a una diferencia de temperatura. Cuando aumentamos la temperatura del material, los átomos y moléculas se mueve más rápido, incrementando su energía cinética o calor. La temperatura no depende del número ni el tamaño de las partículas de un material sino de su velocidad media.
si tienes dudas con la medida de la temperatura puedes ingresar al link y ver el video de unidades de medida.
http://www.investiciencias.com/componentes/quimica-11/154-gases.html?showall=1&limitstart=
Teoría cinético molecular de los gases
Para poder comprender las características y predecir el comportamiento de los gases, se empleó un modelo conocido como teoría cinética, que afirma que el estado y comportamiento de los materiales está directamente relacionado con su estructura interna. Esta teoría plantea que la materia está formada por pequeñas partículas en constante movimiento y el calor es una señal de ese movimiento.
Postulados de la teoría cinética de los gases:
1. Un gas está conformada por una gran cantidad de partículas (moléculas) que se encuentran en continuo movimiento.
2. Cada una de estas partículas posee una energía cinética que depende su temperatura, por esta razón, la temperatura se considera como una medida de la energía cinética promedio de todas las partículas que conforman un material.
3. La distancia entre las moléculas es grande en comparación con el tamaño de las mismas. El volumen ocupado por un gas consiste principalmente en un espacio vacío.
4. Las partículas del gas se mueven continuamente al azar en línea recta chocando rápidamente entre sí unas con otras y contra las paredes del recipiente que las contienen.
Leyes de los Gases
Ley de los gases Ideales
Se han desarrollado leyes empíricas que relacionan las variables macroscópicas con base en las experiencias realizadas en laboratorios. En los gases ideales, estas variables incluyen la presión (P), el volumen (V) y la temperatura (T).
Ley de Boyle - Mariotte relaciona inversamente las proporciones de volumen y presión de un gas, manteniendo la temperatura constante:
P1. V1 = P2 . V2
Ley de Charles afirma que el volumen de un gas a presión constante, es directamente proporcional a la temperatura absoluta:
V1/T1 = V2/T2 = V1T2
= V2T1
Ley de Gay- Lussac sostiene que, a volumen constante, la presión de un gas es directamente proporcional a la temperatura absoluta del sistema:
P1/T1 = P2/T2 = P1T2 = P2T1
Ley universal de los gases
De las tres leyes anteriores se deduce
P1/T1 =P2/T2; V1/T1 = V2/T2; P1.V1=P2.V2
POR LO TANTO
P1.V1.T2 =
P2.V2.T1
Ley de los Gases Generalizada
Con base en la hipótesis de Avogadro puede considerarse una generalización de la ley de los gases. Si el volumen molar (volumen que ocupa un mol de molécula de gas) es el mismo para todos los gases en (condiciones de temperatura y presión normales) CNPT, entonces podemos considerar que es el mismo para todos los gases ideales a cualquier temperatura y presión que se someta el sistema. Esto es cierto debido a que las leyes que gobiernan los cambios de volumen de los gases con variaciones de temperatura y presión, son las mismas para todos los gases ideales. Se relaciona entonces, proporcionalmente, el número de moles (n), el volumen, la presión y la temperatura: P.V ~ n T. Para establecer una igualdad debemos añadir una constante (R) quedando
Con base en la hipótesis de Avogadro puede considerarse una generalización de la ley de los gases. Si el volumen molar (volumen que ocupa un mol de molécula de gas) es el mismo para todos los gases en (condiciones de temperatura y presión normales) CNPT, entonces podemos considerar que es el mismo para todos los gases ideales a cualquier temperatura y presión que se someta el sistema. Esto es cierto debido a que las leyes que gobiernan los cambios de volumen de los gases con variaciones de temperatura y presión, son las mismas para todos los gases ideales. Se relaciona entonces, proporcionalmente, el número de moles (n), el volumen, la presión y la temperatura: P.V ~ n T. Para establecer una igualdad debemos añadir una constante (R) quedando
P.V = n . R . T
El valor de R se calcula a partir del volumen molar enR = PV/nT
Presiòn 1 atm.
Volumen 22,4 L
1 n= 1 mol.
Temperatura 273,15
K = 0.08205 atm.L/mol.K
Tomado de: http://clasesdequimica.blogspot.com.co/2008/04/leyes-de-los-gases.html
Ley de Dalton o ley de las presiones parciales: esta mezcla se realiza cuando hay dos o más clases de gases y vapor de agua en un mismo recipiente, para aplicarlas es importante tener en cuenta la presión atmosférica.
Presiòn 1 atm.
Volumen 22,4 L
1 n= 1 mol.
Temperatura 273,15
K = 0.08205 atm.L/mol.K
Tomado de: http://clasesdequimica.blogspot.com.co/2008/04/leyes-de-los-gases.html
Ley de Dalton o ley de las presiones parciales: esta mezcla se realiza cuando hay dos o más clases de gases y vapor de agua en un mismo recipiente, para aplicarlas es importante tener en cuenta la presión atmosférica.
Ptotal= p1 + p2 + p3
Densidad y peso molecular
Debemos recordar que la densidad de un vaso está dada por la relación entre su masa y su volumen, pero como el volumen de un gas depende su temperatura y su presión, se puede utilizar la ley de los gases ideales.
d= g/V = P. pm/RT
Se puede decir entonces que en condiciones normales la densidad de un gas es directamente proporcional a su peso molecular pm, por lo tanto si conocemos la densidad a una determinada presión y temperatura, se puede calcular su peso molecular y también se puede obtener la densidad de un gas a cualquier temperatura y presión, si se conoce su densidad a una determinada temperatura y presión.
Veamos cómo se deduce la fórmula para hallar la densidad de un gas a partir de la ley general de los gases
P.V = n . R . T
P.V = m/pm . R . T
P.pm = m/V . R . T
P.pm/R.T = m/V
d = P. pm/R.T
ACTIVIDAD
https://www.youtube.com/watch?v=B-hy27Bpnzg
https://www.youtube.com/watch?v=PsLcfO_qaDQ
https://www.youtube.com/watch?v=oHKp64xKoFk
https://www.youtube.com/watch?v=2WraKdtJnws
Link de apoyo para los ejercicios
https://www.youtube.com/watch?v=ie7fJB-CLKU
https://www.youtube.com/watch?v=lKVyn7BSZ8g
https://www.youtube.com/watch?v=xkaXgemEk5A
ÁCIDOS Y BASES
https://www.google.com/search?q=acidos+y+base&rlz=1C1SQJL_esCO812CO812&source=lnms&tbm=isch&sa=X&ved=0ahUKEwjD6tjSj4XgAhWPt1kKHfUeDNoQ_AUIDigB&biw=1152&bih=704#imgrc=rkgdM_otndrVjM:
Realizar en el laboratorio experimentación y exposición de uno de los postulados de las Leyes que rigen el comportamiento de los gases; debe tener cartelera informativa sobre la ley y los materiales requeridos para ello. A continuación se presentan algunos link de apoyo.
https://www.youtube.com/watch?v=B-hy27Bpnzg
https://www.youtube.com/watch?v=PsLcfO_qaDQ
https://www.youtube.com/watch?v=oHKp64xKoFk
https://www.youtube.com/watch?v=2WraKdtJnws
ACTIVIDAD
1. Tomar ideas principales en el cuaderno
3. Realizar los SIGUIENTES ejercicios propuestos sobre GASES, también serán enviados a su correo electrónico por la plataforma Class-room
3. Realizar los SIGUIENTES ejercicios propuestos sobre GASES, también serán enviados a su correo electrónico por la plataforma Class-room
Link de apoyo para los ejercicios
https://www.youtube.com/watch?v=ie7fJB-CLKU
https://www.youtube.com/watch?v=lKVyn7BSZ8g
https://www.youtube.com/watch?v=xkaXgemEk5A
https://www.google.com/search?q=acidos+y+base&rlz=1C1SQJL_esCO812CO812&source=lnms&tbm=isch&sa=X&ved=0ahUKEwjD6tjSj4XgAhWPt1kKHfUeDNoQ_AUIDigB&biw=1152&bih=704#imgrc=rkgdM_otndrVjM:
PROPIEDADES
ACTIVIDAD
Conteste las siguientes preguntas en su cuaderno, según el link de apoyo.
http://www.100ciaquimica.net/temas/tema8/index.htm
Según el mecanismo de reacción, cuales son las tres reacciones fundamentales?
Defina cada una de las reacciones fundamentales.
1.Según las reacciones acido-base, ¿Cuáles son las características de los ácidos y con que compuestos reaccionan? De ejemplo de cada uno.
2.Según las reacciones acido-base, ¿Cuáles son las características de las bases y con que compuestos reaccionan? De un ejemplo.
3.Realice un cuadro comparativo del concepto de ácido-base según: Svante Arrehenius (1884),; N. Brönsted y T. M. Lowry (1923) y G. N. Lewis (1923).
4. Según el concepto de ácido-base según: Svante Arrehenius (1884), que significa Ka, Kb, PKa, pKb y FRA.
5.Del concepto de ácido-base según: N. Brönsted y T. M. Lowry (1923): Que es una base conjugada y acido conjugado, realice la tabla de ácidos y más comunes.
http://www.100ciaquimica.net/temas/tema8/index.htm
Según el mecanismo de reacción, cuales son las tres reacciones fundamentales?
Defina cada una de las reacciones fundamentales.
1.Según las reacciones acido-base, ¿Cuáles son las características de los ácidos y con que compuestos reaccionan? De ejemplo de cada uno.
2.Según las reacciones acido-base, ¿Cuáles son las características de las bases y con que compuestos reaccionan? De un ejemplo.
3.Realice un cuadro comparativo del concepto de ácido-base según: Svante Arrehenius (1884),; N. Brönsted y T. M. Lowry (1923) y G. N. Lewis (1923).
4. Según el concepto de ácido-base según: Svante Arrehenius (1884), que significa Ka, Kb, PKa, pKb y FRA.
5.Del concepto de ácido-base según: N. Brönsted y T. M. Lowry (1923): Que es una base conjugada y acido conjugado, realice la tabla de ácidos y más comunes.
ACTIVIDADES DE RECUPERACIÓN Y MEJORAMIENTO FINAL
















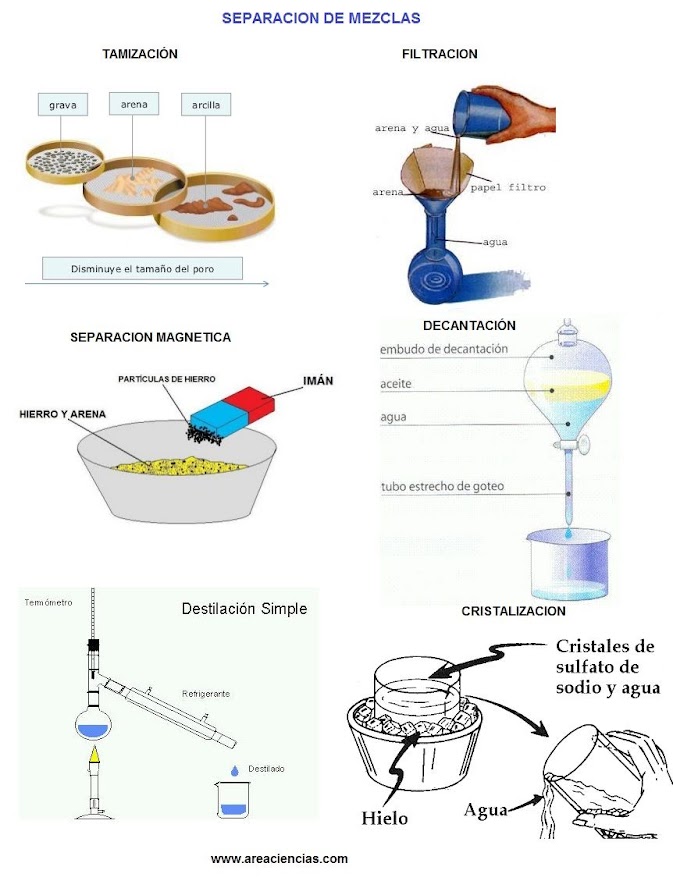























































































No hay comentarios:
Los comentarios nuevos no están permitidos.