COLEGIO MORALBA SUR ORIENTAL
AREA DE CIENCIAS NATURALES Y EDUCACION
AMBIENTAL
CICLO III
JORNADA MAÑANA - TARDE
INDICADORES DE LOGRO 2019
EJE TEMATICO:
IDENTIFICANDO Y ORGANIZANDO CONCEPTOS PARA RESOLVER NECESIDADES DE MÍ ENTORNO
ASIGNATURA: BIOLOGÎA GRADO:
SEPTIMO
CICLO
|
GRADO
|
PERIODO
|
INDICADORES
DE LOGRO
|
III
|
SÉPTIMO
|
I
|
1. Organiza
el proceso del método científico para expresar su conocimiento sobre
la conformación y función de los componentes celulares.
2. Interpreta y argumenta los conceptos de
división y reproducción celular
3. Interpreta y argumenta el concepto de tejidos
vegetales y tejidos animales.
4. Capta asimila y domina el concepto de
reproducción en los seres vivos.
|
II
|
1. Identifica
las características de la excreción en los seres vivos.
2. Conoce
los cuidados que debe dar a sus
órganos para que adopte hábitos de
vida saludable evitando enfermarse.
3. Analiza y soluciona los talleres y actividades
correspondientes al sistema locomotor.
4. describe los componentes del sistema locomotor
humano.
|
||
III
|
1. Analiza y reconoce los conceptos de relaciones
intraespecificas e inter específicas en un ecosistema.
2. Interpreta, diferencia y reconoce las
distintas formas de contaminación del medio ambiente.
3. Identifica los diferentes características fisicoquímicas de los elementos, de acuerdo
a los criterios de la tabla periodica.
4. Identifica las características de las ondas, la luz y el sonido.
|
CONTENIDOS
PRIMER TRIMESTRE
SISTEMAS
BIOLÓGICOS
Reproducción
celular
●
Mitosis
●
Meiosis
●
Citocinesis
PROCESOS
BIOLÓGICOS
Histología
Diferenciación
celular y diversificación histológica
Origen de los tejidos.
Organización celular de los seres vivos.
Tejidos
vegetales
Tejidos
animales (muscular, nervioso y conectivo).
PROCESOS
BIOLÓGICOS
Reproducción
en animales y vegetales.
Reproducción
humana.
●
sistema reproductor masculino
●
testículos, glándulas accesorias, uretra, pene.
●
Fisiología
●
sistema reproductor femenino
●
Embarazo
●
Enfermedades de transmisión sexual
Control de la natalidad
SEGUNDO TRIMESTRE
EXCRECIÓN
●
celular
●
Vegetal
●
Humana
SISTEMA LOCOMOTOR HUMANO
SISTEMA ÓSEO
●
Tejido óseo
●
Estructura de los huesos
●
Estructura de los huesos
●
Sistema óseo humano
●
Anatomía comparada del sistema de sostén en
invertebrados
SISTEMA MUSCULAR
●
tejido muscular
●
fisiología del movimiento
TERCER TRIMESTRE
PROCESOS
ECOSISTÉMICOS
Relaciones
en los ecosistemas
●
Relaciones intraespecíficas
●
Relaciones ínter específicas
●
Relaciones de energía
●
Relaciones de flujo de energía
Alteraciones
en los ecosistemas
●
Contaminación del aire.
●
Contaminación del agua
●
Contaminación del suelo
Biomas
●
características de los biomas
●
ecosistemas en Colombia
● adaptaciones
● adaptaciones
PROCESOS
FISICOQUÍMICOS
Teoría
atómica
●
Estructura atómica
●
Modelos atómicos
●
Distribución electrónica
●
Número atómico
●
Número másico
●
Iones
●
Isótopos
Partículas subatómicas
Radioactividad
●
Partículas alfa
●
Partículas beta
●
Partículas gamma
Enlaces
●
Enlace iónico
●
Enlace covalente
Ondas y movimiento ondulatorio
●
Conceptos preliminares de ondas
●
Clases de ondas
●
Propagación de las ondas
●
Propiedades de las ondas
El
sonido
●
Propagación del sonido
●
Aplicaciones de las ondas sonoras
La luz
●
La energía luminosa
●
Propagación de luz
●
Luz visible y los colores
●
Velocidad de la luz
PLATAFORMAS EVALUATIVAS
Socrative
Kahoot
PRESENTACIÓN DE PROYECTOS
Pixton
Classtool.net
Educaplay
Powtoon.com
Classroom
(Tener un correo electrónico con todo su nombre Ej maritzamayorlopez@gmail.com)
Paycanuas
Stency
Goanimate
scratchJr
PRIMER TRIMESTRE
CONCEPTO Y PASOS DE MÉTODO CIENTÍFICO
ACTIVIDAD: Teniendo en cuenta el siguiente link. realizar en mapa conceptual sobre el concepto y los 8 pasos del método científico.
División
celular
Proceso por
el cual, a partir de una célula inicial, se forman al menos dos células hijas.
Se compone de una división nuclear o cariocinesis y de una división
citoplasmática o citocinesis.
Son
divisiones celulares tanto la mitosis, en las que las dos células hijas
mantienen el número de cromosomas de la célula madre, como la meiosis, en la
que el número de cromosomas de las cuatro células resultantes es inferior al de
la célula original.
https://www.cun.es/diccionario-medico/terminos/division-celular
La célula, necesita realizar la división celular como
parte importante de su ciclo, donde el resultado final es dar lugar a dos
células hijas. Este proceso es esencial en el crecimiento de los seres vivos.
Se compone de dos partes:
- Cariocinesis: La división del núcleo.
- Citocinesis: La división del
citoplasma.
Tanto la cariocinesis como la citocinesis pueden ocurrir de forma asociada
o independiente, primero el núcleo y poco después, el citoplasma. Aunque para
que se divida el núcleo, debe producirse la replicación del material
genético.
La replicación del
material genético
Replicación es el proceso por el cual
el material genético, es decir, las moléculas de ADN son copiadas de forma
complementaria mediante unas enzimas llamadas ADN-polimerasas. Este
proceso, donde la célula está duplicando su cantidad de ADN, se realiza antes
de la división, durante la Interfase, que es ese espacio de
tiempo donde la célula no se está dividiendo.
Después de replicar el ADN, la célula quedará con la cantidad necesaria de
ADN para realizar la mitosis, es decir, para separar esas cadenas
de ADN, y repartirlas entre sus células hijas. Pero para que esto ocurra, el
material genético, pasará del estado de cromatina a un estado
en forma de cromosomas.
Cariocinesis
o Mitosis
Se trata de un proceso de división nuclear donde se reparten las cadenas de
ADN a sus células hijas, quedando finalmente la misma información genética que
la célula madre tenía. Diferenciamos 4 fases durante la mitosis,
que detallamos a continuación:
1. Profase: Lo primero es el paso de cromatina a cromosomas, donde las
cadenas de ADN se espiralizan y se comprimen. También, los centriolos se
duplican y desaparece la membrana nuclear. Cuando ya no tenemos membrana
nuclear, los centriolos se desplazan a los extremos, y entre ellos se forman
una serie de fibras proteicas, conocido como huso acromático.
Sobre las fibras se unen los cromosomas por su centrómero, quedando éstos
en la zona central de la célula. En el caso de las células vegetales no
apreciamos los centriolos ni el huso acromático.
2. Metafase: Durante esta fase, todos los cromosomas están en la parte central de
la célula, formando lo que se conoce como placa ecuatorial.
3. Anafase: Aquí ocurre la separación de las cromátidas hacia los centriolos
desapareciendo las fibras del huso y quedando repartido el material genético
en dos zonas opuestas.
4. Telofase: Finalmente se desenrollan los cromosomas que dan lugar de nuevo a la
cromatina, se vuelve a formar la membrana nuclear, con lo que tendríamos dos
núcleos en una misma célula.
Citocinesis
Como antes comentamos, conocemos la citocinesis como la parte de la división
correspondiente a la división del citoplasma. Es decir, cada núcleo hijo se
queda con parte del citoplasma que al finalizar la mitosis, ha aumentado en
tamaño y orgánulos, con lo que hay un reparto aproximadamente igual del
contenido. En células animales este proceso se realiza por una especie de estrangulación,
es como si del exterior se fuera cerrando la membrana hasta separar las dos
células hijas. En el caso de la célula vegetal se forma una pared celular desde
el interior hasta el exterior, algo así como si dentro de una habitación,
formaras un muro para separarla en dos partes.
Resumen de la cantidad
de ADN en la célula durante la división celular
- Durante
la interfase, la célula madre, tiene su material genético en
forma de cromatina(cadenas aisladas), es decir, tiene 46
cadenas de ADN.
- Al final
de la interfase, la célula madre duplica su material genético mediante
el proceso de replicación, por lo que en ese momento tendrá 92
cadenas de ADN.
- Durante
la división celular, las cadenas de ADN forman 46 cromosomas,
formados por dos cadenas idénticas de ADN.
Y este proceso, ocurre constantemente en nuestro cuerpo, tan complejo, y a
la vez ¡tan rápido!
https://www.hidden-nature.com/la-division-celular/
https://www.google.com/search?q=DIVISION+CELULAR&source=lnms&tbm=isch&sa=X&ved=0ahUKEwi_1Pejz5XgAhURvlkKHYUsDwUQ_AUIDigB&biw=1366&bih=657#imgrc=V-9mewBvPkAOuM
:
MEIOSIS
La meiosis es
un tipo de división celular particular, reduccional y luego igualitaria, en la
que una célula diploide con 2n cromosomas permite el nacimiento de 4 células
haploides con n cromosomas.
Definición de
meiosis
La meiosis
consiste en dos divisiones sucesivas del núcleo, pero sólo una duplicación
cromosóma.
:
A continuación encontraras una pagina muy interesante sobre el proceso de Meiosis, deberás sacar resumen puede ser mapa conceptual de cada de las dos divisiones con sus respectivas fases y hacer los dibujos correspondientes.
links de consulta
https://www.asturnatura.com/articulos/nucleo-mitosis-meiosis/fases-meiosis.php
https://kerchak.com/meiosis/.
PRÁCTICA DE LABORATORIO No. 1
http://www.ing.unp.edu.ar/asignaturas/quimica/practicos_de_laboratorio_pdf/lab1.pdf
ACTIVIDAD
Con relación al link anterior, realizar las siguientes actividades, una vez haber realizado lectura comprensiva del texto donde se tiene en cuenta: Reconocimiento de material , clasificación y técnicas fundamentales de laboratorio.
Cada grupo de trabajo deberá realizar las actividades propuestas, contestar las preguntas, exponer una de las 9 técnicas planteadas en el texto así como entregar un informe de laboratorio una vez transcurridos 8 días de realizada la práctica.
Función del monitor: Coordinar que la exposición (con cartelera) de las técnicas de laboratorio no este repetida entre los demás grupos de trabajo, entregar el informe de laboratorio, organizar el material requerido para la práctica, en éste caso grupo No. 1.
Nota: Cada estudiante deberá tener dibujado en el cuaderno, la tabla de materiales propuesta con su bebida clasificación.
1. Reconocimiento de material
Dibujar y analizar la tabla dada así podrá clasificaros en alguna de las categorías mencionadas.
2. Clasificación
Volumétrico
Calentamiento o sostén
Equipos de medición
Equipos especiales
t 3. Técnicas fundamentales de laboratorio: Para exposición
1. Orden Y Uso De Los Reactivos
2. Manejo Del Tubo De Ensayo
3. Manejo Del Mechero De Gas
4. Balanza
5. Material De Vidrio
6. Manejo De Drogas
7. Lectura De Volúmenes
8. Medición Con Pipeta
9. Medición Con Probeta
TEJIDOS
Los tejidos son cúmulos o grupos de células organizadas para
realizar una o más funciones. Aunque con frecuencia se dice que la células es
la unidad funcional del organismo, en realidad los tejidos son responsables del
mantenimiento de las funciones corporales, gracias a los esfuerzos cooperativos
de sus células individuales.
Los
tejidos se clasifican acorde al objeto de estudio, en referencia se pueden
distinguir los tejidos vegetales y los tejidos animales (entre los cuales se encuentra los tejidos de la raza
humana, a razón de nuestra condición de animales pensantes)
CLASIFICACIÓN DE LOS TEJIDOS ANIMAL Y VEGETAL
https://www.google.com/search?q=TEJIDOS+ANIMAL+Y+VEGETAL&source=lnms&tbm=isch&sa=X&ved=0ahUKEwiI15XI_8fgAhVuplkKHfR2C0MQ_AUIDigB&biw=1366&bih=657#imgrc=D0yI0vGxo-vUxM:
ACTIVIDAD
.
Según el siguiente link, define y dibuja cada
uno de los tejidos vegetales:
Tejido
superficial
Tejido
fundamental
tejido
vascular
tejido
meristemàtico
Según el
siguiente link, define y dibuja cada uno de los tejidos animales:
Epitelial
Conectivo
Muscular
Nervioso
link
https://biologia121lardizabal.files.wordpress.com/2014/03/tejidos-animales-y-vegetales.pdff
REPRODUCCIÓN EN LOS SERES VIVOS
LA
FUNCIÓN REPRODUCCIÓN
La reproducción es una de las funciones esenciales de los
seres vivos, que asegura la supervivencia de las especies a lo largo del
tiempo, dando lugar a nuevos individuos semejantes a ellos mismos.
Mediante la reproducción un organismo origina una célula,
o un grupo de células, que tras un proceso de desarrollo, da origen a un nuevo
organismo de la misma especie, posibilitando la supervivencia de la misma.
Existen dos modalidades de reproducción:
- La reproducción asexual
- La reproducción sexual
La
reproducción asexual
Es un proceso sencillo, donde un solo progenitor da
origen a sus descendientes. Los descendientes son idénticos al progenitor al tener
la misma información genética.
Ventaja Al
ser un proceso sencillo y rápido, genera numerosos descendientes, lo que asegura
la supervivencia de la especie.
Desventaja Al
ser todos los organismos idénticos, todos tienen la misma adaptación al entorno
y cualquier cambio medioambiental puede afectarles negativamente. Se da en bacterias, hongos, plantas y
animales invertebrados
La
reproducción sexual
Es un mecanismo complejo donde dos progenitores dan
origen a los descendientes. Los descendientes presentan diferencias con los progenitores
debido a la mezcla de la información genética de los mismos.
Ventaja Su ventaja es que se originan descendientes con
características variables, con distinta capacidad de adaptación al entorno, lo
que aumenta las posibilidades desupervivencia de la especie en caso de cambios
medioambientales.
Desventaja
Es
que es un proceso complicado, que requiere la formación de células especializadas,
su unión en la fecundación, un desarrollo embrionario complejo y tras el
nacimiento, distintos tipos de cuidados en el caso de los animales.
http://recursostic.educacion.es/secundaria/edad/2esobiologia/2quincena10/pdf/pdf_q10.pdf
Reproducción
asexual
La reproducción asexual se clasifica según los organismo, Organismos unicelulares y pluricelulares, a continuación encontraras las diversas formas de epsucciòn, con ayuda del siguiente
define y dibuja cada proceso:
link:
define y dibuja cada proceso:
Organismos unicelulares
·
Bipartición
·
Gemación
·
Esporulación
·
Pluriparticiòn
Organismos
pluricelulares
·
Gemación
·
Escisión
·
Fragmentación
·
Esporulación
·
Partenogénesis
http://recursostic.educacion.es/secundaria/edad/2esobiologia/2quincena10/pdf/pdf_q10.pdf
Reproducción sexual
Reproducción
sexual
Gametogénesis
Fecundación
Desarrollo embrionario
Reproducción
sexual en plantas
Musgos .
Helechos
Gimnospermas
Angiospermas
Reproducción
sexual en animales
Cnidarios
Insectos
Anfibios y peces
Reptiles y aves
Mamíferos
Reproducción
Humana
SEGUNDO TRIMESTRE
TERCER TRIMESTRE
ENLACE QUÍMICO
En química, un dato experimental importante es que sólo los gases nobles y los metales en estado de vapor se presentan en la naturaleza como átomos aislados, en la mayoría de los materiales que nos rodean los elementos están unidos por enlaces químicos.
Enlace significa unión, un enlace químico es la unión de dos o más átomos con un solo fin, alcanzar la estabilidad, tratar de parecerse al gas noble más cercano. Para la mayoría de los elementos se trata de completar ocho electrones en su último nivel.
Molécula de H2 |
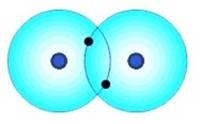
1s1 1s1
|
Las fuerzas atractivas que mantienen juntos los elementos que conforman un compuesto, se explican por la interacción de los electrones que ocupan los orbitales más exteriores de ellos (electrones de valencia).
Cuando dos átomos se acercan se ejercen varias fuerzas entre ellos. Algunas de estas fuerzas tratan de mantenerlos unidos, otras tienden a separarlos.
En la mayoría de los átomos, con excepción de los gases nobles (muy estables, con su última capa o nivel de energía completo con sus ocho electrones), las fuerzas atractivas son superiores a las repulsivas y los átomos se acercan formando un enlace.
Así, podemos considerar al enlace químico como la fuerza que mantiene unidos a dos o más átomos dentro de una molécula.
Todos los enlaces químicos resultan de la atracción simultánea de uno o más electrones por más de un núcleo.
Electrones de Valencia
En la mayoría de los átomos, muchos de los electrones son atraídos con tal fuerza por sus propios núcleos que no pueden interaccionar de forma apreciable con otros núcleos. Sólo los electrones que ocupan los niveles de energía más alejados del núcleo de un átomo pueden interaccionar con dos o más núcleos. A éstos se les llama electrones de valencia
La unión consiste en que uno o más electrones de valencia de algunos de los átomos se introduce en la esfera electrónica del otro.
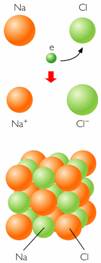 |
| La ilustración describe cristales de Cloruro de sodio (enlace químico iónico). |
Aquí debemos recordar que el número de electrones de valencia de un átomo es igual al número de su familia o grupo (que corresponden a las 18 divisiones verticales) en la tabla periódica, usando sólo la antigua numeración romana.
Así, tenemos un electrón de valencia para los elementos de los grupos IA (o grupo 1) y IB (o grupo 11); dos electrones de valencia para los elementos de los grupos IIA y IIB (o grupos 2 y 12), y cuatro para los elementos de los grupos IVB y IVA (o grupos 4 y 14).
Regla del octeto
Los átomos tienden a perder, ganar o compartir electrones en forma tal que queden con un total de 8 electrones en su nivel energético más exterior, esta configuración les proporciona gran estabilidad.
Estructura o Notación de Lewis
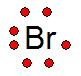 |
La notación o estructura de Lewis es una representación gráfica que muestra la cantidad de electrones de valencia que hay en el último orbital.
La estructura de Lewis fue propuesta por Gilbert Lewis, la cantidad de electrones de valencia se representan con puntos alrededor del elemento químico (símbolo), como vemos a la derecha en el ejemplo del Br.
Iones
Los átomos están constituidos por el núcleo y la corteza (capas o niveles de energía que ocupan los electrones). El número de cargas positivas (cantidad de protones) del núcleo es igual al número de electrones que giran en la corteza; de ahí su el electronegatividad (que en estado neutro es cero, y significa igual cantidad de protones a igual cantidad de electrones). Si la corteza electrónica de un átomo neutro pierde o gana electrones se forman los llamados iones.
Entonces, los iones son átomos o grupos atómicos que tienen un número mayor o menor de electrones que de protones.
En el primer caso (más electrones) los iones tienen carga negativa y reciben el nombre de aniones, y en el segundo (menos electrones) están cargados positivamente y se llaman cationes.
Elementos electropositivos y electronegativos
Se llaman elementos electropositivos aquellos que tienen tendencia a perder electrones transformándose en cationes; a ese grupo pertenecen los metales.
En cambio, elementos electronegativos son los que toman con facilidad electrones transformándose en aniones; a este grupo pertenecen los metaloides.
Los elementos más electropositivos (tendencia a perder electrones) están situados en la parte izquierda del sistema o tabla periódica; son los llamados elementos alcalinos. A medida que se avanza en cada período hacia la derecha va disminuyendo el carácter electropositivo, llegándose, finalmente, a los alógenos de fuerte carácter electronegativo (elementos con tendencia a tomar electrones).
A modo de resumen:
Ion: átomo o conjunto de átomos que poseen carga eléctrica (han cedido o han captado electrones).
Catión: ion con carga positiva (ha cedido electrones). Ejemplo: Ca+2 ion calcio, NH4+ ion amonio
Anión: ion con carga negativa (ha captado electrones). Ejemplo: Br– ion bromuro, ClO2– ion clorito
|
EJEMPLOS:
El sodio tiene un potencial de ionización bajo y puede perder fácilmente su electrón ubicado en el subnivel 3s
El sodio tiene un potencial de ionización bajo y puede perder fácilmente su electrón ubicado en el subnivel 3s
| Na0 |
→
|
Na+
|
+
|
1e–
|
1s2 2s2 2p6 3s1
|
→
|
1s2 2s2 2p6
|
+
|
1e–
|
átomo de sodio
|
ion de sodio
|
La estructura electrónica del ion sodio resultante es exactamente igual a la del gas noble neón. Este ion es una especie muy estable.
Otros elementos ganan electrones para llenar la capa de valencia y alcanzar la configuración estable de 8 electrones. El cloro es un ejemplo:
| Cl0 |
→
|
1e–
|
+
|
Cl–
|
1s2 2s2 2p6 3s2 3p5
|
→
|
+
|
1s2 2s2 2p6 3s2 3p6
| |
átomo de cloro
|
ion cloruro
|
Tipos de enlaces
Como dijimos al principio, el hecho de que los átomos se combinen o enlacen para formar nuevas sustancias se explica por la tendencia a conformar estructuras más estables. De ahí que dichos enlaces químicos sean considerados como un incremento de estabilidad.
Para lograr ese estado ideal estable, los átomos pueden utilizar algún método que les acomode, eligiendo entre: ceder o captar electrones, compartir electrones con otro átomo o ponerlos en común junto con otros muchos.
De estas tres posibilidades nacen los tres tipos de enlace químico: iónico, covalente y metálico.
Tomando como base la diferencia de electronegatividad entre los átomos que forman un enlace se puede predecir el tipo de enlace que se formará:
| Si la diferencia de electronegatividades es mayor que 2. |
=
|
se formará un enlace iónico
|
Si la diferencia de electronegatividades es mayor que 0,5 y menor a 2,0.
|
=
|
el enlace formado será covalente polar
|
Si la diferencia de electronegatividades es menor a 0,5
|
=
|
el enlace será covalente puro (o no polar).
|
Enlace iónico
Cuando una molécula de una sustancia contiene átomos de metales y no metales, los electrones son atraídos con más fuerza por los no metales, que se transforman en iones con carga negativa; los metales, a su vez, se convierten en iones con carga positiva.
Entonces, los iones de diferente signo se atraen electrostáticamente, formando enlaces iónicos.
Este enlace se origina cuando se transfiere uno o varios electrones de un átomo a otro. Debido al intercambio electrónico, los átomos se cargan positiva y negativamente, estableciéndose así una fuerza de atracción electrostática que los enlaza. Se forma entre dos átomos con una apreciable diferencia de electronegatividades, los elementos de los grupos I y II A forman enlaces iónicos con los elementos de los grupos VI y VII A.
Enlace iónico: Molécula de NaCl |
 |
En general, cuando el compuesto está constituido por un metal y un no-metal y además la diferencia en electronegatividades es grande, el compuesto es iónico. Es el caso del bromuro de potasio (KBr).
Propiedades de un enlace iónico
Los productos resultantes de un enlace iónico poseen características especiales:
• Son sólidos de elevado punto de fusión y ebullición.
• La mayoría son solubles en disolventes polares como el agua.
• La mayoría son insolubles en disolventes apolares como el benceno o el hexano.
• Las sustancias iónicas conducen la electricidad cuando están en estado líquido o en disoluciones acuosas por estar formados por partículas cargadas (iones), pero no en estado cristalino, porque los iones individuales son demasiado grandes para moverse libremente a través del cristal.
• Al intentar deformarlos se rompe el cristal, son frágiles.
Enlace covalente
Se presenta cuando se comparten uno o más pares de electrones entre dos átomos cuya diferencia de electronegatividad es pequeña.
Enlace covalente apolar (o no polar)
Si los átomos enlazados son no metales e idénticos (como en N2 o en O2), los electrones son compartidos por igual por los dos átomos, y el enlace se llama covalente apolar.
Se establece entre átomos con igual electronegatividad. Átomos del mismo elemento presentan este tipo de enlace.
Enlace covalente apolar: Molécula de N2
(Usando la Notación de Lewis)
|
Ver: PSU: Química; Pregunta 09_2006
En este enlace covalente no polar, la densidad electrónica es simétrica con respecto a un plano perpendicular a la línea entre los dos núcleos. Esto es cierto para todas las moléculas diatómicas homonucleares (formadas por dos átomos del mismo elemento) , tales como H2, O2, N2, F2 y Cl2, porque los dos átomos idénticos tienen electronegatividades idénticas. Por lo que podemos decir: los enlaces covalentes en todas las moléculas diatómicas homonucleares deben ser no polares. Por ejemplo, una molécula de dióxido de carbono (CO2) es lineal con el átomo de carbono al centro y, por lo tanto, debido a su simetría es covalente apolar.
Enlace covalente polar
Si los átomos son no metales pero distintos (como en el óxido nítrico, NO), los electrones son compartidos en forma desigual y el enlace se llama covalente polar (polar porque la molécula tiene un polo eléctrico positivo y otro negativo, y covalente porque los átomos comparten los electrones, aunque sea en forma desigual).
Se establece entre átomos con electronegatividades próximas pero no iguales.
Estas sustancias no conducen la electricidad ni tienen brillo, ductilidad o maleabilidad.
Veamos un ejemplo:
¿Qué tipo de enlace se formará entre H y O?
Según la Tabla de Electronegatividades de Pauli, el Hidrógeno tiene una electronegatividad de 2,2 y el Oxígeno 3,44, por lo tanto la diferencia de electronegatividades será: 3,44 – 2,2 = 1,24.
El resultado de la operación entrega 1,24 cifra que es menor que 2,0 y mayor que 0,5.
Por lo tanto, el enlace será covalente polar. Además, si no se conociera la electronegatividad de los elementos bastaría saber que son dos no metales distintos para definir su enlace como covalente polar.
Enlace covalente coordinado
Se establece por compartición de electrones entre dos átomos, pero sólo un átomo aporta el par de electrones compartidos.
Propiedades de los enlaces covalentes
• Son gases, líquidos o sólidos de bajo punto de fusión.
• La mayoría son insolubles en disolventes polares.
• La mayoría son solubles en disolventes apolares.
• Los líquidos y sólidos fundidos no conducen la electricidad.
• Las disoluciones acuosas son malas conductoras de la electricidad porque no contienen partículas cargadas.
Enlace metálico
Si los átomos enlazados son elementos metálicos, el enlace se llama metálico. Los electrones son compartidos por los átomos, pero pueden moverse a través del sólido proporcionando conductividad térmica y eléctrica, brillo, maleabilidad y ductilidad.
Los electrones que participan en él se mueven libremente, a causa de la poca fuerza de atracción del núcleo sobre los electrones de su periferia.
Cuando los electrones son compartidos simétricamente, el enlace puede ser metálico o covalente apolar; si son compartidos asimétricamente, el enlace es covalente polar; la transferencia de electrones proporciona enlace iónico. Generalmente, la tendencia a una distribución desigual de los electrones entre un par de átomos aumenta cuanto más separados están en la tabla periódica.
Cómo se forman los enlaces covalentes no polares y polares
Al contrario de los enlaces iónicos, en los cuales ocurre una transferencia completa de electrones, el enlace covalente ocurre cuando dos (o más) elementos comparten electrones.
El enlace covalente ocurre porque los átomos en el compuesto tienen una tendencia similar hacia los electrones (generalmente para ganar electrones). Esto ocurre comúnmente cuando dos no metales se enlazan. Ya que ninguno de los no metales que participan en el enlace querrá ganar electrones, estos elementos compartirán electrones para poder llenar sus envolturas de valencia.
Un buen ejemplo de un enlace covalente es ese que ocurre entre dos átomos de hidrógeno.
Los átomos de hidrógeno (H) tienen un electrón de valencia en su primera y única capa o envoltura. Puesto que la capacidad de esta envoltura es de dos electrones, cada átomo hidrógeno tenderá a captar un segundo electrón.
Enlace covalente apolar entre dos átomos de hidrógeno (H) |
En un esfuerzo por recoger un segundo electrón, el átomo de hidrógeno reaccionará con átomos H vecinos para formar el compuesto H2. Ya que el compuesto de hidrógeno es una combinación de átomos igualados, los átomos compartirán cada uno de sus electrones individuales, formando así un enlace covalente. De esta manera, ambos átomos comparten la estabilidad de una envoltura de valencia.
Siempre que dos átomos del mismo elemento se enlazan (formando moléculas diatómicas homonucleares), tendremos un enlace no polar.
Otro ejemplo de enlace covalente apolar (no polar), pero con átomos diferentes, es el metano (CH4).
La electronegatividad del carbono es 2,5 y la del hidrógeno es 2,1; la diferencia entre ellos es de 0,4 (menor de 0,5), por lo que el enlace se considera no polar. Además, el metano es una molécula muy simétrica, por lo que las pequeñas diferencias de electronegatividad en sus cuatro enlaces se anulan entre sí.
En cambio, se forma un enlace polar cuando los electrones son desigualmente compartidos (permanecen más tiempo cerca de un átomo que del otro) entre dos átomos. Los enlaces covalentes polares ocurren porque un átomo tiene una mayor afinidad hacia los electrones que el otro (sin embargo, no tanta como para empujar completamente los electrones y formar un ión).
Esto quiere decir que, en un enlace covalente polar los electrones que se enlazan pasarán un mayor tiempo alrededor del átomo que tiene la mayor afinidad hacia los electrones. Un buen ejemplo del enlace covalente polar es el enlace hidrógeno - oxígeno en la molécula de agua.
1. ¡Que es enlace químico?
2. ¿Defina cada una de las clases de enlace quimico?
3. ¿Cuales son las propiedades de cada uno de los enlaces químicos?
4. Realizar 5 ejemplos de cada unos de los enlaces químicos vistos?
5. Realice un mapa conceptual donde involucre los diversos tipos de enlaces, clases, propiedades.
2. ¿Defina cada una de las clases de enlace quimico?
3. ¿Cuales son las propiedades de cada uno de los enlaces químicos?
4. Realizar 5 ejemplos de cada unos de los enlaces químicos vistos?
5. Realice un mapa conceptual donde involucre los diversos tipos de enlaces, clases, propiedades.










muy buen bloc :v
ResponderEliminarte quiero
ResponderEliminarjajja :v
hola profe sora :3 soi juan da vid cortes avila mui buenas sus clases
ResponderEliminarprofesora soy juan camilo aragon mi pregunta es como se pone la pagina de wordpress de tejidos me aparece un error
ResponderEliminarprofe soy jefferson no me permite entrar al link que nos dejo me aparese archivo no encontrado que puedo hacer??
ResponderEliminarde los tejidos vegetal y animal
ResponderEliminarBuenos días profe con Juan Manuel 701
ResponderEliminaruna pregunta cuál es la recuperación es que me robaron el cuaderno entonces me puede escribir a el correo porfa mi correo es juanmanuelromeroperez05@gmail.com
profe la coperacion del trabajo que nos mando no me aparece como el tema que estamos trabajando soy de 702 porfa si me puede ayudar
ResponderEliminar